题目内容
19.下列实验现象,解释或结论正确的是( )| 选项 | 实验现象 | 解释或结论 |
| A | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中龠Na+,不含K+ |
| B | 向某溶液中滴加KSCN溶液,无明显现象,再滴加 少量氯水,溶液变成红色 | 溶液中含有Fe2+,没有Fe3+ |
| C | 向苯中滴入少量浓溴水,振荡,精置分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 在少量无水乙醇中加入金属Na+,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.K元素焰色反应必须透过蓝色钴玻璃观察;
B.铁离子和KSCN溶液反应产生血红色溶液,亚铁离子和KSCN不反应,但能被氯气氧化生成铁离子;
C.苯和溴水不反应,但能萃取溴水中的溴;
D.乙醇在水溶液中以分子存在.
解答 解:A.K元素焰色反应必须透过蓝色钴玻璃观察,从而滤去黄光的干扰,该实验没有透过蓝色钴玻璃观察,所以不能确定是否含有钾离子,故A错误;
B.铁离子和KSCN溶液反应产生血红色溶液,亚铁离子和KSCN不反应,但能被氯气氧化生成铁离子,向某溶液中滴加KSCN溶液,无明显现象,说明不含铁离子,再滴加少量氯水,溶液变成红色,说明含有亚铁离子,故B正确;
C.苯和溴水不反应,但能萃取溴水中的溴,该现象是萃取而不是发生取代反应,苯和液溴在溴化铁作萃取剂条件下能发生取代反应,故C错误;
D.乙醇在水溶液中以分子存在,乙醇是非电解质,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及焰色反应、离子检验、萃取、电解质和非电解质判断,明确实验原理、基本概念、基本操作、离子性质是解本题关键,注意C中发生的现象为物理现象,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③已知上述工业固氮反应的反应热△H=-92kJ/mol,1molN2、1molH2分子中的化学键断裂所吸收的能量分别为946kJ、436kJ,则N-H键断裂所吸收的能量为391kJ/mol.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系:р2>р1.

(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③已知上述工业固氮反应的反应热△H=-92kJ/mol,1molN2、1molH2分子中的化学键断裂所吸收的能量分别为946kJ、436kJ,则N-H键断裂所吸收的能量为391kJ/mol.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系:р2>р1.

7.某溶液中只可能含有K+、Mg2+、Al3+、Br-、OH-、CO32-、SO32-中的一种或几种.取样,滴加足量氯水,有气泡产生,溶液变为橙色;向橙色溶液中加BaCl2溶液无明显现象.为确定该溶液的组成,还需进行的实验是( )
| A. | 取样,进行焰色反应 | |
| B. | 取样,滴加酚酞试液 | |
| C. | 取样,加入足量稀HNO3,再滴加AgNO3溶液 | |
| D. | 取样,加入足量BaCl2溶液,再滴加紫色石蕊试液 |
4.下列物质不属于危险品的是( )
| A. | 硝化甘油 | B. | 苯 | C. | 重晶石 | D. | 硝酸铵 |
11.扑热息痛的结构如图所示 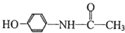 ,下列关于扑热息痛的描述正确的是( )
,下列关于扑热息痛的描述正确的是( )
 ,下列关于扑热息痛的描述正确的是( )
,下列关于扑热息痛的描述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 扑热息痛易溶于水 | |
| C. | 能与Na2CO3溶液反应,但不能与NaHCO3溶液反应 | |
| D. | 属于芳香烃 |
8.下列操作或装置能达到实验目的是( )
| 选项 | A | B | C | D |
| 操作或装置 |  | 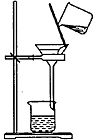 | 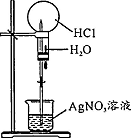 | 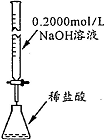 |
| 目的 | 配制一定物质的量浓度溶液 | 分离Na2CO2溶液和CH3COOC2H5的混合物 | 做“白色”喷泉实验 | 用NaOH溶液滴定稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
9.下列各示意图与对应表述正确的是( )
| A. |  为证明非金属性强弱:S>C>Si | |
| B. | 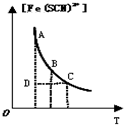 表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓度[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)<V(逆) | |
| C. | 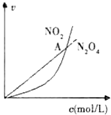 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. | 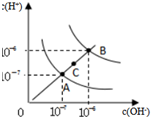 为水的电离平衡曲线图,若从A点到C点,可在水中加入适量NaOH固体 |
 ,分子的立体构型为V型,中心原子的杂化轨道类型为sp3杂化.
,分子的立体构型为V型,中心原子的杂化轨道类型为sp3杂化.
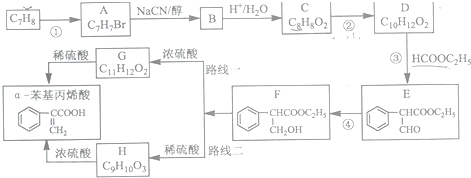


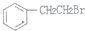 制备
制备 的合成路线.
的合成路线.