题目内容
(1)1.5molH2SO4的质量是 ,含 个分子,完全中和消耗NaOH的物质的量是 ,该硫酸所含氢元素的质量与 mol H3PO4中所含氢元素的质量相同.
(2)等质量的O2和O3,它们的物质的量之比为 ,所含分子数之比为 ,含相同原子数目的甲烷(CH4)和氨气(NH3),它们在标准状况下的体积之比为 .
(3)15.6g Na2X中含Na+0.4mol,则Na2X的摩尔质量为 ,X的相对原子质量为 .
(2)等质量的O2和O3,它们的物质的量之比为
(3)15.6g Na2X中含Na+0.4mol,则Na2X的摩尔质量为
考点:物质的量的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)根据m=nM计算1.5molH2SO4的质量;再根据N=nNA计算分子数目;
硫酸与NaOH按物质的量之比1:2反应,据此计算NaOH的物质的量;
每个H2SO4分子含有2个H原子,则n(H)=2n(H2SO4 ),含有氢元素质量相等,则H原子物质的量相等,计算n(H3PO4);
(2)根据n=
可知,等质量的O2和O3,它们的物质的量之比与摩尔质量成反比;根据N=nNA可知,分子数目之比等于物质的量之比;同温同压下的气体体积之比等于它们的物质的量之比;
(3)15.6g Na2X含Na+0.4moL,则Na2X的物质的量为0.2mol,根据M=
计算该化合物的摩尔质量,摩尔质量在数值上等于其相对分子质量或相对原子质量;
硫酸与NaOH按物质的量之比1:2反应,据此计算NaOH的物质的量;
每个H2SO4分子含有2个H原子,则n(H)=2n(H2SO4 ),含有氢元素质量相等,则H原子物质的量相等,计算n(H3PO4);
(2)根据n=
| m |
| M |
(3)15.6g Na2X含Na+0.4moL,则Na2X的物质的量为0.2mol,根据M=
| m |
| n |
解答:
解:(1)1.5mol H2SO4 的质量=1.5mol×98g/mol=147g;分子数目为1.5NA;硫酸与NaOH按物质的量之比1:2反应,消耗NaOH的物质的量=2×1.5mol=3mol;每个H2SO4分子含有2个H原子,则n(H)=2n(H2SO4 )=2×1.5mol=3mol,含有氢元素质量相等,则H原子物质的量相等,则n(H3PO4)=
×1mol=1mol,
故答案为:147 g;1.5NA;3 mol;1;
(2)根据n=
可知,等质量的O2和O3,它们的物质的量之比=48g/mol:32g/mol=3:2;
根据N=nNA可知,O2和O3所含分子数目之比=O2和O3物质的量之比=3:2;
含相同原子数目的甲烷(CH4)和氨气(NH3),它们的物质的量之比为
:
=4:5,同温同压下的气体体积之比等于它们的物质的量之比,即为4:5;
故答案为:3:2;3:2;4:5;
(3)15.6g Na2X含Na+0.4moL,则Na2X的物质的量为0.2mol,该化合物的摩尔质量M=
=
=78g/mol,X的相对原子质量=78-23×2=32,
故答案为:78g/mol;32.
| 3 |
| 3 |
故答案为:147 g;1.5NA;3 mol;1;
(2)根据n=
| m |
| M |
根据N=nNA可知,O2和O3所含分子数目之比=O2和O3物质的量之比=3:2;
含相同原子数目的甲烷(CH4)和氨气(NH3),它们的物质的量之比为
| 1 |
| 5 |
| 1 |
| 4 |
故答案为:3:2;3:2;4:5;
(3)15.6g Na2X含Na+0.4moL,则Na2X的物质的量为0.2mol,该化合物的摩尔质量M=
| m |
| n |
| 15.6g |
| 0.2mol |
故答案为:78g/mol;32.
点评:本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法中正确的是( )
| A、饮用水可以用明矾、漂白粉来净化,两者的作用原理相同 |
| B、常温常压下,78gNa2O2固体中所含阴离子数一定为NA |
| C、NH4Cl、MgCl2均为离子化合物,均含有离子键和共价键 |
| D、实验室中浓硝酸保存在带橡胶塞的棕色细口试剂瓶中 |
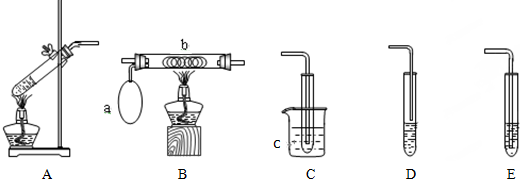
 加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,用图所示装置探究废旧塑料的再利用.下列叙述不正确的是( )
加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,用图所示装置探究废旧塑料的再利用.下列叙述不正确的是( )| A、丙烯分子中共用电子对数为10 |
| B、装置B的试管中可收集到芳香烃 |
| C、装置C中的试剂可吸收烯烃以制取卤代烃 |
| D、最后收集的气体可做燃料 |
《中华人民共和国食品安全法》于2009年6月1日起实施,下列说法不利于食品安全的是( )
| A、在食盐中添加适量的碘酸钾 |
| B、在食品加工中严格按照剂量标准科学使用食品添加剂 |
| C、研发高效低毒的农药,降低蔬菜的农药残留量 |
| D、用聚氯乙烯塑料袋包装食品 |
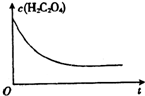 某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.
某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.