题目内容
6.Zn还原SiCl4的反应如下:SiCl4(g)+2Zn(l)?Si(s)+2ZnCl2(g)△H1
SiCl4(g)+2Zn(g)?Si(s)+2ZnCl2(g)△H2
下列说法正确的是( )
| A. | Zn(l)=Zn(g)△H=$\frac{1}{2}$(△H1-△H2) | |
| B. | 用硅制作的太阳能电池是将化学能转化为电能 | |
| C. | 增加 Zn(g)的量,△H2变大 | |
| D. | Zn-Cu-CuSO4溶液构成的原电池中,Cu片质量增加,Zn片质量不变 |
分析 A、根据盖斯定律,分析解答;
B、用硅制作的太阳能电池是将光能转化为电能;
C、反应热是反应物和生成物的总能量之差;
D、锌作为负极,发生氧化反应生成锌离子.
解答 解:A、根据盖斯定律,可知:Zn(l)=Zn(g)△H=$\frac{1}{2}$(△H1-△H2),故A正确;
B、用硅制作的太阳能电池是将光能转化为电能,而不是化学能转化为电能,故B错误;
C、反应热是反应物和生成物的总能量之差,所以增加 Zn(g)的量,△H2不变,故C错误;
D、锌作为负极,发生氧化反应生成锌离子,所以Cu片质量增加,Zn片质量减小,故D错误;
故选A.
点评 本题考查盖斯定律、反应热的计算和原电池的反应原理等,难度中等,理解盖斯定律并根据盖斯定律构造目标热化学方程式是解答本题的关键.

练习册系列答案
相关题目
16.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| B. | 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.01 NA | |
| C. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 标准状况下,NA个CO2分子占有的体积为22.4 L |
17.下列药品可用带玻璃塞的试剂瓶存放的是( )
| A. | NaOH溶液 | B. | Na2CO3溶液 | C. | 盐酸 | D. | Na2SiO3溶液 |
14.除去下列物质中所含的杂质(括号内为杂质),选用试剂正确的是( )
| A. | FeCl2溶液(FeCl3):Fe粉 | B. | CO2(SO2):饱和的Na2CO3溶液 | ||
| C. | Al2O3(SiO2):NaOH溶液 | D. | Cl2(HCl):NaOH溶液 |
1.如图,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是( )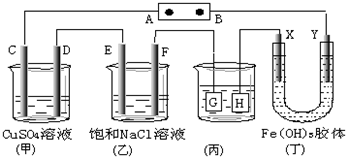

| A. | 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| D. | C、D、E、F电极均有单质生成,其物质的量比为1:1:2:2 |
11.下列说法正确的是( )
| A. | H2SO4、CH3CH2OH、CH3COONa和CaO分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| D. | 日常生活中无水乙醇常用于杀菌消毒 |
18.下列说法正确的是( )
| A. | PH值均为12的氨水和氢氧化钠溶液各10 mL,分别加水稀释至100 mL,氨水溶液的PH值变化较大 | |
| B. | 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 | |
| C. | FeI2的溶液中,缓慢通入少量氯气,再滴加少量CCl4,振荡,静置,下层液体为紫色 | |
| D. | 量筒、滴定管、容量瓶都可以用来量取液体,量筒、滴定管都有“0”刻度,量筒“0”刻度在下面,滴定管“0”刻度在上面,容量瓶有标线无其它刻度,滴定管和容量瓶使用前都需要检查是否漏水 |
15.研究电化学腐蚀及防护的装置如图所示.下列有关说法错误的是( )
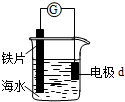

| A. | d为石墨,电流从d流入导线进入铁片 | |
| B. | d为铜片,铜片上电极反应为:O2+2H2O+4e-═4OH- | |
| C. | d为锌块,铁片不易被腐蚀 | |
| D. | d为镁片,铁片上电极反应为:2H++2e-═H2↑ |
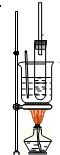 实验室制取硝基苯的方法如图所示:
实验室制取硝基苯的方法如图所示: ,
,