题目内容
5.有一未完成的离子方程式( )+XO3-+6H+═3X2+3H2O,据此判断下列说法错误的是( )| A. | X原子最外层电子数为5 | |
| B. | 当有3mol X2生成时,转移5mol电子 | |
| C. | 氧化产物和还原产物的物质的量之比为5:1 | |
| D. | “( )”括号中所填的微粒为X- |
分析 由( )+XO3-+6H+═3X2+3H2O可知,XO3-中X元素的化合价由+5价降低为0价,则( )中离子中X元素的化合价必定升高,以此来解答.
解答 解:由( )+XO3-+6H+═3X2+3H2O可知,XO3-中X元素的化合价由+5价降低为0价,则( )中离子中X元素的化合价必定升高,由电子和电荷守恒可知,( )中为5X-,
A.最低价为-1价,其最高价为+7价,最外层电子数为7,故A错误;
B.当有3mol X2生成时,共有5mol电子转移,故B正确;
C.氧化产物、还原产物均为X2,XO3-得到电子对应还原产物,则氧化产物和还原产物的物质的量之比为5:1,故C正确;
D.“( )”括号中所填的微粒为X-,故D正确;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握( )中微粒的判断及反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
15.下列说法不正确的是( )
| A. | 氧化还原反应的特征是元素化合价发生了变化 | |
| B. | 在水溶液中能电离出H+的化合物不一定是酸 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定不相同 | |
| D. | 因为NH3溶于水的溶液能导电,所以NH3是电解质 |
13.下列说法正确的是( )
| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 阿伏加德罗常数是 12kg12C中含有的碳原子数 | |
| C. | 1molH2O中含有2mol H和1mol O | |
| D. | 一个NO分子的质量是ag,一个NO2分子的质量是bg,则氧原子的摩尔质量是(b-a)g/mol |
20.在强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Cu2+、OH-、SO42- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Zn2+、NH4+、NO3+、Cl- | D. | K+、Na+、CO32-、SO42- |
7.用无机矿物资源生产部分材料,其产品流程示意图如下:下列有关说法正确的是( )
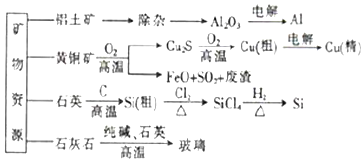

| A. | 制取玻璃和粗硅的同时均产生CO2气体 | |
| B. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用过滤的方法(SiCl4的熔点-70℃,沸点57.7℃) | |
| D. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |
8.用30mL某浓度的Na2SO3溶液,恰好将2×10-3 mol XO4-还原,元素X在还原产物中的化合价是+1价,则Na2SO3溶液的浓度为( )
| A. | 0.2mol/L | B. | 0.1mol/L | C. | 0.3 mol/L | D. | 0.4mol/L |
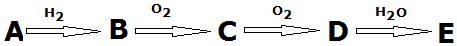
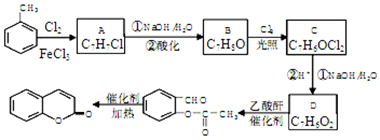
 ,A→B的反应类型是取代反应.
,A→B的反应类型是取代反应.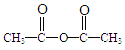 )反应,除生成
)反应,除生成 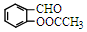 外,同时生成的另一种产物的结构简式是CH3COOH.
外,同时生成的另一种产物的结构简式是CH3COOH.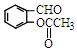 互为同分异构体,且具有以下特点:
互为同分异构体,且具有以下特点: