题目内容
13.下列说法正确的是( )| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 阿伏加德罗常数是 12kg12C中含有的碳原子数 | |
| C. | 1molH2O中含有2mol H和1mol O | |
| D. | 一个NO分子的质量是ag,一个NO2分子的质量是bg,则氧原子的摩尔质量是(b-a)g/mol |
分析 A.摩尔是物质的量的单位;
B.1mol任何粒子的粒子数叫做阿伏伽德罗常数;
C.1个H2O分子是由2个H和1个O构成;
D、根据摩尔质量的定义来分析.
解答 解:A.摩尔是物质的量的单位,不是物质的数量的单位,故A错误;
B.1mol任何粒子的粒子数叫做阿伏伽德罗常数,1mol任何粒子的粒子数与0.012kg 12C中含有的碳原子数目相同,故B错误;
C.1个H2O分子是由2个H和1个O构成,所以1molH2O中含有2mol H和1mol O,故C正确;
D、一个NO分子的质量是ag,一个NO2分子的质量是bg,则一个氧原子的质量为(b-a)g,根据摩尔质量即1mol物质所具有的质量可知,氧原子的摩尔质量为(b-a)NAg/mol,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是关键,难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
3.常温下0.1mol•L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2mol•L-1盐酸 | D. | 提高溶液的温度 |
1.无色溶液中放入铝片后有氢气产生,则下列离子在该溶液中一定不能大量存在的( )
| A. | Na+ | B. | Mg2+ | C. | H+ | D. | HCO3- |
8.氮及其化合物在生产生活中有着重要作用.
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g);△H<0,其平衡常数K与温度T的关系如表:
①试判断K2K1<(填写“>”“=”或“<”)②在298K时,下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2b.v(N2)=3v(H2)c.容器内压强保持不变d.混合气体的密度保持不变
(2)化合物N2H4做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解100mL-定浓度NaCl与CuSO4混合溶液,其装置如图所示.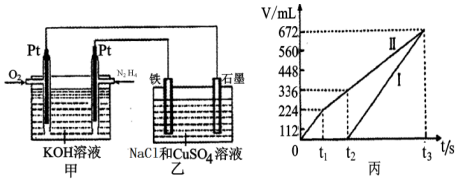
①该燃料电池的负极反应式为;N2H4+4OH--4e-=N2↑+4H2O,②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),原混合溶液中NaCl的物质的量浓度为0.2mol/L.③在t2时所得溶液的pH为0.7.(假设溶液体积不变,保留一位小数,lg2=0.3)
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g);△H<0,其平衡常数K与温度T的关系如表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2b.v(N2)=3v(H2)c.容器内压强保持不变d.混合气体的密度保持不变
(2)化合物N2H4做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解100mL-定浓度NaCl与CuSO4混合溶液,其装置如图所示.

①该燃料电池的负极反应式为;N2H4+4OH--4e-=N2↑+4H2O,②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),原混合溶液中NaCl的物质的量浓度为0.2mol/L.③在t2时所得溶液的pH为0.7.(假设溶液体积不变,保留一位小数,lg2=0.3)
18.饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉NO3-还原为N2,反应的转化为:Al+NaNO3+NaOH→NaAlO2+N2+H2O(未配平)下列有关该反应说法不正确的是( )
| A. | NaOH表现碱性 | |
| B. | NaNO3是氧化产物,N2是还原产物 | |
| C. | 每生成1molN2转移10mole- | |
| D. | 氧化剂与还原剂物质的量之比为5:3 |
5.有一未完成的离子方程式( )+XO3-+6H+═3X2+3H2O,据此判断下列说法错误的是( )
| A. | X原子最外层电子数为5 | |
| B. | 当有3mol X2生成时,转移5mol电子 | |
| C. | 氧化产物和还原产物的物质的量之比为5:1 | |
| D. | “( )”括号中所填的微粒为X- |
15.下列离子方程式,书写正确的是( )
| A. | 盐酸与碳酸钡反应 CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| C. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 铁与稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ |
16.下列说法与胶体有关且正确的是( )
| A. | 食盐水不会发生丁达尔效应 | |
| B. | 稀豆浆能通过半透膜 | |
| C. | 用氢氧化铁胶体进行电泳实验时,阴极(与电源负极相连)附近顔色加深,说明氢氧化铁胶体带正电 | |
| D. | 将装有淀粉溶液的半透膜袋浸入蒸馏水中,一段时间后往蒸馏水中滴入碘液,不变蓝 |
 .该反应中氧化剂为HNO3,被还原的元素是N,每生成3.36L标准状况下的气体,转移电子数目为0.45NA(或2.709×1023).
.该反应中氧化剂为HNO3,被还原的元素是N,每生成3.36L标准状况下的气体,转移电子数目为0.45NA(或2.709×1023).