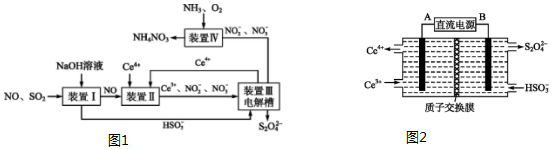
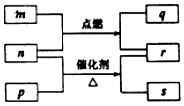
题目内容
20.在强酸性溶液中,能大量共存的离子组是( )| A. | K+、Cu2+、OH-、SO42- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Zn2+、NH4+、NO3+、Cl- | D. | K+、Na+、CO32-、SO42- |
分析 强酸溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能相互促进水解等,则离子大量共存,以此来解答.
解答 解:A.酸性条件下OH-不能大量共存,且Cu2+、OH-反应生成沉淀,故A错误;
B.酸溶液中该组离子之间不反应,可大量共存,故B正确;
C.酸溶液中该组离子之间不反应,可大量共存,故C正确;
D.酸性条件下CO32-不能大量共存,故D错误.
故选BC.
点评 本题考查离子检验的实验评价,为高频考点,把握离子检验的试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意检验时排除干扰离子,题目难度不大.

练习册系列答案
相关题目
10.焰火表演,精彩纷呈,有着浓厚的地方特色,让人惊叹不已.下列关于焰色反应的说法正确的是( )
| A. | 每次焰色反应实验前,铂丝要先用硫酸洗涤 | |
| B. | 用固体样品或配成相应的溶液进行焰色反应,现象相同 | |
| C. | 焰色反应均应透过蓝色钴玻璃观察 | |
| D. | 非金属单质燃烧时火焰均为无色 |
11.下列根据实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向氢氧化镁的饱和溶液中滴加FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| B | 等浓度的Na2CO3和Na2SO3溶液的pH,前者>后者 | 非金属性S>C |
| C | 金属镁片和铝片用灵敏电流计相连,伸入烧碱溶液中,发现镁片上有气泡 | 金属性Mg<A1 |
| D | 冰醋酸中加入水,氢离子浓度先增大,后减小 | 醋酸的电离程度先增大后减小 |
| A. | A | B. | B | C. | C | D. | D |
8.氮及其化合物在生产生活中有着重要作用.
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g);△H<0,其平衡常数K与温度T的关系如表:
①试判断K2K1<(填写“>”“=”或“<”)②在298K时,下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2b.v(N2)=3v(H2)c.容器内压强保持不变d.混合气体的密度保持不变
(2)化合物N2H4做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解100mL-定浓度NaCl与CuSO4混合溶液,其装置如图所示.
①该燃料电池的负极反应式为;N2H4+4OH--4e-=N2↑+4H2O,②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),原混合溶液中NaCl的物质的量浓度为0.2mol/L.③在t2时所得溶液的pH为0.7.(假设溶液体积不变,保留一位小数,lg2=0.3)
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g);△H<0,其平衡常数K与温度T的关系如表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2b.v(N2)=3v(H2)c.容器内压强保持不变d.混合气体的密度保持不变
(2)化合物N2H4做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解100mL-定浓度NaCl与CuSO4混合溶液,其装置如图所示.

①该燃料电池的负极反应式为;N2H4+4OH--4e-=N2↑+4H2O,②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),原混合溶液中NaCl的物质的量浓度为0.2mol/L.③在t2时所得溶液的pH为0.7.(假设溶液体积不变,保留一位小数,lg2=0.3)
15.在下列反应中,水只作氧化剂的是( )
| A. | 2F2+2H2O═4HF+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
5.有一未完成的离子方程式( )+XO3-+6H+═3X2+3H2O,据此判断下列说法错误的是( )
| A. | X原子最外层电子数为5 | |
| B. | 当有3mol X2生成时,转移5mol电子 | |
| C. | 氧化产物和还原产物的物质的量之比为5:1 | |
| D. | “( )”括号中所填的微粒为X- |
5. 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色.上述的转化关系如图所示.下列说法中不正确的是( )| A. | 原子半径:Y<X<Z | B. | 非金属性:Y>X>W | ||
| C. | m与q、n与s均不能共存 | D. | 若n过量,q还可以继续燃烧 |

 $\stackrel{2R′OH}{→}$2ROH+
$\stackrel{2R′OH}{→}$2ROH+
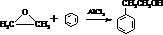 .
. 、
、 .
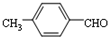
. 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备 的合成路线(须注明必要的反应条件)
的合成路线(须注明必要的反应条件)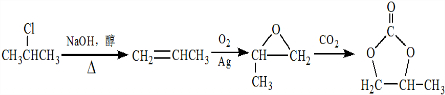 .
.