题目内容
 25℃时,将氨水与氯化铵溶液混合得到c(NH3?H2O)+c(NH4+)=0.1mol?L-1的混合溶液.溶液中c(NH3?H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到c(NH3?H2O)+c(NH4+)=0.1mol?L-1的混合溶液.溶液中c(NH3?H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )| A、W点表示溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| B、pH=10.5溶液中c(Cl-)+c(OH-)+c(NH3?H2O)<0.1 mol?L-1 |
| C、pH=9.5溶液中c(NH3?H2O)>c(NH4+)>c(OH-)>c(H+) |
| D、向W点所表示1L溶液中加入0.05molNaOH固体(溶液体积变化可忽略):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.溶液中一定满足电荷守恒,根据混合液中的电荷守恒分析;
B.已知c(NH3?H2O)+c(NH4+)=0.1mol?L-1,根据电荷守恒和物料守恒分析;
C.pH=9.5时,一水合氨浓度大于铵根离子,溶液显示碱性;
D.W点c(NH3?H2O)=c(NH4+)=0.05mol?L-1,此时加入0.05mol氢氧化钠后得到0.1mol一水合氨、0.05molNaCl.
B.已知c(NH3?H2O)+c(NH4+)=0.1mol?L-1,根据电荷守恒和物料守恒分析;
C.pH=9.5时,一水合氨浓度大于铵根离子,溶液显示碱性;
D.W点c(NH3?H2O)=c(NH4+)=0.05mol?L-1,此时加入0.05mol氢氧化钠后得到0.1mol一水合氨、0.05molNaCl.
解答:
解:A.W点时一水合氨与铵根离子浓度相等,根据电荷守恒可得:c(NH4+)+c(H+)=c(Cl-)+c(OH-),故A正确;
B.已知:c(NH3?H2O)+c(NH4+)=0.1mol?L-1,根据电荷守恒可得:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则c(Cl-)+c(OH-)+c(NH3?H2O)=c(NH4+)+c(H+)+c(NH3?H2O)>0.1mol/L,故B错误;
C.根据图象可知,pH=9.5时,一水合氨浓度大于铵根离子,溶液显示碱性,则溶液中粒子浓度大小为:c(NH3?H2O)>c(NH4+)>c(OH-)>c(H+),故C正确;
D.W点c(NH3?H2O)=c(NH4+)=0.05mol?L-1,向W点所表示1L溶液中加入0.05molNaOH固体后得到0.1mol一水合氨、0.05molNaCl,钠离子与氯离子浓度相等,故D错误;
故选AC.
B.已知:c(NH3?H2O)+c(NH4+)=0.1mol?L-1,根据电荷守恒可得:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则c(Cl-)+c(OH-)+c(NH3?H2O)=c(NH4+)+c(H+)+c(NH3?H2O)>0.1mol/L,故B错误;
C.根据图象可知,pH=9.5时,一水合氨浓度大于铵根离子,溶液显示碱性,则溶液中粒子浓度大小为:c(NH3?H2O)>c(NH4+)>c(OH-)>c(H+),故C正确;
D.W点c(NH3?H2O)=c(NH4+)=0.05mol?L-1,向W点所表示1L溶液中加入0.05molNaOH固体后得到0.1mol一水合氨、0.05molNaCl,钠离子与氯离子浓度相等,故D错误;
故选AC.
点评:本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,明确图象曲线变化及其含义为解答关键,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒、盐的水解原理等知识判断溶液中离子浓度大小.

练习册系列答案
相关题目
用质量均为100g的铜作电极,电解硝酸银溶液,电解一段时间后,两电极的质量差为28g,此时两电极的质量分别为( )
| A、阳极100 g,阴极128 g |
| B、阳极91.0 g,阴极119.0 g |
| C、阳极93.6 g,阴极121.6 g |
| D、阳极86.0 g,阴极114.0 g |
根据表,以下错误的是( )
| 酸 | 电离常数(25℃) |
| HF | Ki=3.6×10 -4 |
H3PO4 | Ki1=7.5×10 -3 Ki2=6.2×10 -8 Ki3=2.2×10 -13 |
| A、NaF和H3PO4反应的产物只有HF、NaH2PO4 |
| B、0.10 mol/L的溶液,pH由大到小的顺序是Na3PO4>Na2HPO4>NaF>NaH2PO4 |
| C、0.10 mol/L的H3PO4溶液中,0.30 mol/L>c(H+)>0.10 mol/L |
| D、25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者 |
在探究SO2的性质实验中,下列根据实验现象得出的结论不正确的是( )
| A、向SO2水溶液中滴加Ba(NO3)2溶液,产生的白色沉淀是BaSO3 |
| B、向溴水中通入SO2,溶液褪色,说明+4价硫具有还原性 |
| C、将过量的SO2通入石蕊溶液中,溶液由紫色变为红色,说明SO2不能漂白石蕊 |
| D、向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3酸性强于H2CO3 |
下列叙述正确的是( )
| A、3.01×1023个SO2分子的质量为32 g |
| B、CH4的摩尔质量为16 g |
| C、1 mol H2O的质量为18 g/mol |
| D、不同的气体,若体积不等,则它们所含的分子数一定不等 |
 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子、C原子的I,能层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息回答:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子、C原子的I,能层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息回答:
 、④CH3COONH4、⑤NH4HCO3
、④CH3COONH4、⑤NH4HCO3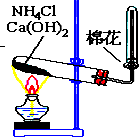 如图所示,是实验室制备某常见气体的实验装置,请填空:
如图所示,是实验室制备某常见气体的实验装置,请填空: