题目内容
[化学一化学与技术模块]某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如下图所示的废水处理流程.
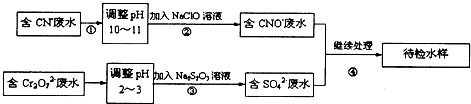
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因
(3)②中反应后无气体放出,该反应的离子方程式为
(4)③中反应时,每0.4mol Cr2O72-转移2.4mol的电子,该反应的离子方程式为.
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少.请解释其原因.
(6)工业制烧碱的一种方法是先制得纯碱,而我国著名化学家侯德榜为此做出了巨大贡献,其原理为(用化学方程式表示),简述先通足量氨气后通入CO2的理由. .

回答以下问题:
(1)上述处理废水的流程中主要使用的方法是
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因
(3)②中反应后无气体放出,该反应的离子方程式为
(4)③中反应时,每0.4mol Cr2O72-转移2.4mol的电子,该反应的离子方程式为.
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少.请解释其原因.
(6)工业制烧碱的一种方法是先制得纯碱,而我国著名化学家侯德榜为此做出了巨大贡献,其原理为(用化学方程式表示),简述先通足量氨气后通入CO2的理由.
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)由转化图及图中的物质可知,NaClO、Cr2O72-离子都具有氧化性,则实现离子的转化是利用氧化还原反应实现的;
(2)利用盐的水解来分析盐溶液显碱性的原因;
(3)CN-离子具有还原性、NaClO具有氧化性,利用氧化还原来分析,并注意无气体生成来判断生成物;
(4)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(5)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析;
(6)氨气极易溶于水,二氧化碳在水中的溶解度较小.
(2)利用盐的水解来分析盐溶液显碱性的原因;
(3)CN-离子具有还原性、NaClO具有氧化性,利用氧化还原来分析,并注意无气体生成来判断生成物;
(4)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(5)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析;
(6)氨气极易溶于水,二氧化碳在水中的溶解度较小.
解答:
解:含有CN-离子的废水中加入次氯酸钠溶液会发生氧化还原反应:CN-+ClO-═CNO-+Cl-,得到含有CNO-、Cl-的溶液,含有Cr2O72-的废水中加入还原剂硫代硫酸钠,会发生氧化还原反应:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,继续处理得到待检水样.
(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法,故答案为:氧化还原法;
(2)NaClO溶液呈碱性,是因次氯酸根离子水解生成氢氧根离子导致的,则离子反应为ClO-+H2O HClO+OH-,故答案为:ClO-+H2O
HClO+OH-,故答案为:ClO-+H2O HClO+OH-;
HClO+OH-;
(3)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-,故答案为:CN-+ClO-═CNO-+Cl-;
(4)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(5)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化,故答案为:待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
(6)侯氏制碱法:向饱和的氯化钠溶液中通入氨气和二氧化碳,可以得到溶解度较小的碳酸氢钠,加热碳酸氢钠可得到碳酸钠,NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,2NaHCO3
Na2CO3+H2O+CO2;由于二氧化碳在水中的溶解度较小,氨气极易溶于水,所以应该先通氨气有利于吸收二氧化碳,否则就不能生成大量HCO3-.
故答案为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,2NaHCO3
Na2CO3+H2O+CO2;只有先通入足量氨气使溶液呈碱性后才能吸收大量CO2,否则就不能生成大量HCO3-.
(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法,故答案为:氧化还原法;
(2)NaClO溶液呈碱性,是因次氯酸根离子水解生成氢氧根离子导致的,则离子反应为ClO-+H2O
 HClO+OH-,故答案为:ClO-+H2O
HClO+OH-,故答案为:ClO-+H2O HClO+OH-;
HClO+OH-; (3)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-,故答案为:CN-+ClO-═CNO-+Cl-;
(4)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(5)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化,故答案为:待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
(6)侯氏制碱法:向饱和的氯化钠溶液中通入氨气和二氧化碳,可以得到溶解度较小的碳酸氢钠,加热碳酸氢钠可得到碳酸钠,NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,2NaHCO3
| ||
故答案为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,2NaHCO3
| ||
点评:本题考查利用氧化还原反应来实现废水的转化,注重了化学与实际生产的联系,学生应学会利用物质的性质、元素的化合价、电子守恒等来解答.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
25℃时,下列溶液中微粒存在情况合理的是( )
| A、Fe2+、Mg2+、ClO-、Cl-能大量共存 | ||
| B、滴入酚酞试液显红色的溶液中:K+、Na+、NO3-、SO42- | ||
C、含大量K+、Na+、NO3-、CO32-的溶液中c(H+)=
| ||
| D、C(Fe3+)=0.1 mol/L的溶液中:NH4+、Al3+、I-、SO42- |
检查烧碱中是否混有纯碱的正确方法是( )
| A、加热看是否有气体生成 |
| B、滴入盐酸后看是否有气体生成 |
| C、溶解后检查溶液的酸碱性 |
| D、灼烧看火焰是否为黄色 |
能将NH4NO3、Na2SO4、KCl、(NH4)2SO4四种溶液一步加以区别(可以加热)的试剂为( )
| A、BaCl2 |
| B、Ba(NO3)2 |
| C、Ba(OH)2 |
| D、AgNO3 |
下列说法不正确的是( )
| A、易溶于水的固体物质与水用蒸馏的方法分离 |
| B、互溶的液体用蒸馏的方法分离 |
| C、互不相容的两种液体用分液的方法分离 |
| D、难溶于水的物质与水用过滤的方法分离 |