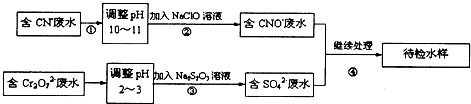
题目内容
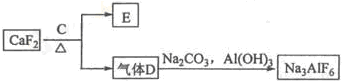
某溶液中含有Ba2+、Cu2+ 和Ag+,现用氢氧化钠、盐酸和硫酸钠溶液将三种离子逐一沉淀分离.其流程如下图所示:(其中“溶液2”为无色溶液)
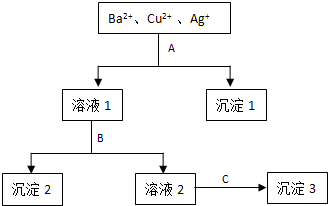
回答下列问题:
(1)沉淀1的化学式: .
(2)写出下列反应的离子方程式:
溶液1+B: .
溶液2+C: .

回答下列问题:
(1)沉淀1的化学式:
(2)写出下列反应的离子方程式:
溶液1+B:
溶液2+C:
考点:物质分离和提纯的方法和基本操作综合应用
专题:元素及其化合物,化学实验基本操作
分析:溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,因溶液2为无色,故过滤后再沉淀铜离子,加入NaOH,可得到Cu(OH)2沉淀,最后加入Na2SO4,可得到BaSO4沉淀,根据物质的性质书写反应的离子方程式.
解答:
解:(1)溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后加入NaOH,可得到Cu(OH)2沉淀,最后加入Na2SO4,可得到BaSO4沉淀,所以沉淀1是氯化银,沉淀2是氢氧化铜,沉淀3是硫酸钡,故答案为:AgCl;
(2)试剂B应是氢氧化钠,溶液1和B反应即氢氧化钠与铜离子生成氢氧化铜沉淀,反应的离子方程式为Cu2++2OH-=Cu(OH)2↓,
试剂C应是硫酸钠,故沉淀3为硫酸钡,溶液2和C反应即硫酸钠与钡离子生成硫酸钡沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓;
故答案为:Cu2++2OH-=Cu(OH)2↓;Ba2++SO42-=BaSO4↓.
(2)试剂B应是氢氧化钠,溶液1和B反应即氢氧化钠与铜离子生成氢氧化铜沉淀,反应的离子方程式为Cu2++2OH-=Cu(OH)2↓,
试剂C应是硫酸钠,故沉淀3为硫酸钡,溶液2和C反应即硫酸钠与钡离子生成硫酸钡沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓;
故答案为:Cu2++2OH-=Cu(OH)2↓;Ba2++SO42-=BaSO4↓.
点评:本题考查离子方程式的书写,题目难度中等,注意使离子逐一沉淀应先加入HCl,不能先加入NaOH,否则不能达到逐一沉淀的目的.“溶液2”为无色溶液容易忽视,易错认为最后沉淀铜离子.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
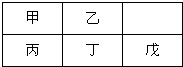 短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )
短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、戊只与强碱反应 |
| C、最高价氧化物对应水化物碱性:乙>丁>戊 |
| D、金属性:丙>甲 |
已知元素R有某种核素的离子Rx+,该离子核内中子数为Y,核外电子数为Z,该核素的符号为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
常温下,下列各组离子一定能大量共存的是( )
| A、滴加石蕊显红色的溶液中:Na+、Fe2+、Cl-、NO3- | ||
B、
| ||
| C、c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- | ||
| D、由水电离的c(H+)=1.0×10-13 mol?L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
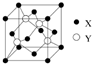 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子的核外电子共有16种运动状态.