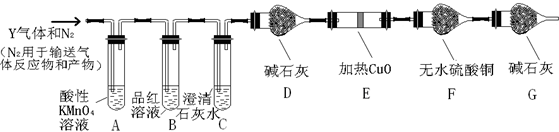
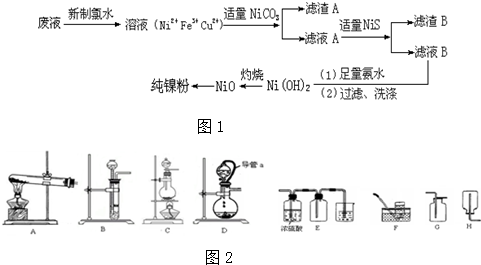
题目内容
17.有关阿佛加德罗常数(NA),下列说法中正确的是( )| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3NA | |
| C. | 0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2NA | |
| D. | 标准状况下,11.2L 四氯化碳所含分子数为0.5NA |
分析 A.根据1mol二氧化硅晶体中含有4mol硅氧键进行判断;
B.二氧化碳和N2O的摩尔质量都是44g/mol,分子中都含有3个原子;
C.氯气溶于水中,只有部分氯气与水反应生成次氯酸和盐酸;
D.标准状况,四氯化碳的状态不是气体,不能使用标况下的气体摩尔体积计算四氯化碳的物质的量.
解答 解:A.1mol二氧化硅晶体中含有4mol硅氧键,含有4NA个Si-O共价键,故A错误;
B.4.4gCO2和N2O混合物中含有分子的物质的量为0.1mol,0.1mol混合气体中含有0.3mol原子,所含有的原子数为0.3NA,故B正确;
C.氯气与水的反应中,只有少量的氯气与水反应生成次氯酸和盐酸,无法计算溶液中转移的电子数,故C错误;
D.标况下四氯化碳不是气体,题中条件无法计算四氯化碳的物质的量,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标准状况下四氯化碳、水、乙醇等不是气体,不能使用标况下的气体摩尔体积计算物质的量或者体积;要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
2.下列说法正确的是( )
| A. | 氧化还原反应的判断依据是看反应前后元素化合价是否发生变化 | |
| B. | 根据是否只含一种元素将物质分为纯净物和混合物 | |
| C. | 根据水溶液是否能导电将化合物分为电解质和非电解质 | |
| D. | 根据是否有丁达尔现象将分散系分为溶液和胶体 |
8.将新制氯水分别滴入下列溶液中,由实验现象得出的结论正确韵是( )
| 选项 | 氯水滴入下列溶液中 | 实验现象 | 结论 |
| A | 滴有KSCN的FeC12溶液 | 变红 | C12具有还原性 |
| B | 滴有石蕊的NaOH溶液 | 褪色 | C12具有酸性 |
| C | 紫色石蕊溶液 | 先变红后褪色 | C12具有漂白性 |
| D | KI淀粉溶液 | 变蓝 | C12具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
5.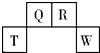 短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
 短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )| A. | R的氢化物可以既有极性键又有非极性键 | |
| B. | 常温下丁的浓溶液可用T单质所制的容器来盛装 | |
| C. | 丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体 | |
| D. | 甲、乙、丙、丁受热均易分解 |
12.已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法正确的是( )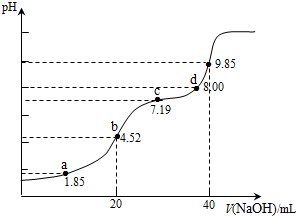

| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c($HS{{{O}_{3}}^{-}}_{\;}$) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
2.下列有关化学用语或表达正确的是( )
| A. | 三硝酸纤维素脂 | B. | 硬酯酸钠 | ||
| C. | 硝酸苯的结构简式: | D. | NaCl晶体模型: |
9.O3是重要的氧化剂和水处理剂,在平流层存在:2O3?3O2,O3?O+O2.粒子X能加速O3的分解:X+O3═XO+O2;XO+O═X+O2(X=Cl、Br、NO等).已知:2O3(g)?3O2(g)△H=-144.8kJ/mol,t℃时K=3×1076.下列说法不正确的是( )
| A. | 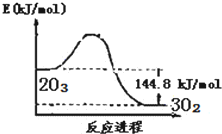 O3转变为O2能量曲线可用图表示 | |
| B. | O3转变为O2为氧化还原反应 | |
| C. | 臭氧层中氟里昂释放出的氯原子是O3分解的催化剂 | |
| D. | t℃时,3O2(g)?2O3(g),K′≈3.33×10-77 |