题目内容
已知反应2NO2(g)+O3(g)?N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图象作出判断正确的是( )
A、 升高温度,平衡常数减小 |
B、 0~3内,反应速率为v(NO2)=0.2mol?L-1 |
C、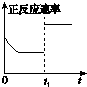 t1时仅加入催化剂,平衡正向移动 |
D、 达平衡时,仅改变x,则x为c(O2) |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:A.由图可知,反应物总能量高于生成物总能量,正反应为放热反应,升高温度平衡向逆反应方向移动;
B.由图可知,0-3s内,二氧化氮的浓度变化量=1mol/L-0.4mol/L=0.6mol/L,根据v=
计算v(NO2),注意选项中单位;
C.使用催化剂,反应速率加快,但平衡不移动;
D.达平衡时,仅增大c(O2),平衡向逆反应方向移动,二氧化氮转化率降低.
B.由图可知,0-3s内,二氧化氮的浓度变化量=1mol/L-0.4mol/L=0.6mol/L,根据v=
| △c |
| △t |
C.使用催化剂,反应速率加快,但平衡不移动;
D.达平衡时,仅增大c(O2),平衡向逆反应方向移动,二氧化氮转化率降低.
解答:
解:A.由图可知,反应物总能量高于生成物总能量,正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,故A正确;
B.由图可知,0-3s内,二氧化氮的浓度变化量=1mol/L-0.4mol/L=0.6mol/L,故v(NO2)=
=0.2mol/(L.s),单位错误,故B错误;
C.t1时刻,改变条件,反应速率加快,平衡不移动,该反应前后气体的物质的量减小,不能是增大压强,只能是使用催化剂,但催化剂不影响平衡的移动,故C错误;
D.达平衡时,仅增大c(O2),平衡向逆反应方向移动,二氧化氮转化率降低,由图可知,二氧化氮的转化率随x增大而增大,x可以代表O3浓度、压强,故D错误,
故选A.
B.由图可知,0-3s内,二氧化氮的浓度变化量=1mol/L-0.4mol/L=0.6mol/L,故v(NO2)=
| 0.6mol/L |
| 3s |
C.t1时刻,改变条件,反应速率加快,平衡不移动,该反应前后气体的物质的量减小,不能是增大压强,只能是使用催化剂,但催化剂不影响平衡的移动,故C错误;
D.达平衡时,仅增大c(O2),平衡向逆反应方向移动,二氧化氮转化率降低,由图可知,二氧化氮的转化率随x增大而增大,x可以代表O3浓度、压强,故D错误,
故选A.
点评:本题以图象形式,考查化学反应中能量变化、化学反应速率计算、化学平衡图象及影响因素等,难度中等,B选项为易错点,学生容易忽略单位问题.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1 mol?L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B、NaA溶液的pH=8,c(Na+)-c(A-)=9.9×10-7 mol?L-1 |
| C、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(OH-)=c(H+)+c(S2-)+2c(HS-)+3c(H2S) |
| D、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
 光气的分解反应为:COCl2(g)═Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是 ( )
光气的分解反应为:COCl2(g)═Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是 ( )| A、从第10 min到第12 min时,生成Cl2的速率v(Cl2)=0.01 mol?L-1?min-1 |
| B、第8 min时与第18 min时反应的平衡常数相同 |
| C、由于10 min时条件的改变,使COCl2的转化率降低 |
| D、在第14 min时,改变的条件可能是压缩反应容器的体积 |
常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
| A、某溶液中由水电离出的c(H+)1×10-a mol/L,若a>7时,该溶液pH一定为14-a |
| B、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)>c(HR-)>c(Na+) |
| C、将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>C(Na+)>c(A-) |
| D、CaCO3是一种难溶物质,其KSP=2.8×10-9(25℃),若将等体积bmol/LCaCl2溶液与2×10-5mol/LNa2CO3溶液混合,则生成沉淀所需原CaCl2溶液的b值至少为1.4×10-4 |



 (-R、-R′、-R″表示可能相同或可能不同的原子或原子团)
(-R、-R′、-R″表示可能相同或可能不同的原子或原子团) 有多种同分异构体,符合下列要求的有
有多种同分异构体,符合下列要求的有