题目内容
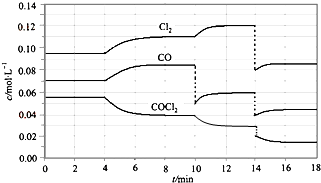 光气的分解反应为:COCl2(g)═Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是 ( )
光气的分解反应为:COCl2(g)═Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是 ( )| A、从第10 min到第12 min时,生成Cl2的速率v(Cl2)=0.01 mol?L-1?min-1 |
| B、第8 min时与第18 min时反应的平衡常数相同 |
| C、由于10 min时条件的改变,使COCl2的转化率降低 |
| D、在第14 min时,改变的条件可能是压缩反应容器的体积 |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:A、根据图象中Cl2在10~12 min时浓度变化为0.01mol/L,据V=
进行计算;
B、根据平衡常数仅与温度有关来判断;
C、由图可知,10min时CO浓度突然减小,Cl2没变,改变条件是减少CO浓度;
D、14min时改变条件,是增大体积,降低压强.
| △c |
| △t |
B、根据平衡常数仅与温度有关来判断;
C、由图可知,10min时CO浓度突然减小,Cl2没变,改变条件是减少CO浓度;
D、14min时改变条件,是增大体积,降低压强.
解答:
解:A、根据图象中Cl2在10~12 min时浓度变化为0.01mol/L,所以Cl2在10~12 min时平均反应速率V=
=
=0.005mol?L-1?min-1,故A错误;
B、根据C、D的分析说明第8 min时与第18 min时温度没变,所以平衡常数不变,故B正确;
C、由图可知,10min时CO浓度突然减小,Cl2没变,改变条件是减少CO浓度,减少生成物的浓度平衡正移,所以COCl2的转化率增大,故C错误;
D、14min时反应物和生成物浓度都瞬间变小,所以改变的条件应是增大体积,降低压强,故D错误;
故选B.
| △c |
| △t |
| 0.01mol/L |
| 2min |
B、根据C、D的分析说明第8 min时与第18 min时温度没变,所以平衡常数不变,故B正确;
C、由图可知,10min时CO浓度突然减小,Cl2没变,改变条件是减少CO浓度,减少生成物的浓度平衡正移,所以COCl2的转化率增大,故C错误;
D、14min时反应物和生成物浓度都瞬间变小,所以改变的条件应是增大体积,降低压强,故D错误;
故选B.
点评:本题考查化学平衡图象、平衡常数、化学平衡与反应速率的影响因素,题目难度中等,根据平衡常数与改变条件的瞬间各物质的浓度变化判断条件是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关
Ti和
Ti的说法中正确的是( )
48 22 |
50 22 |
A、
| ||||
B、
| ||||
C、
| ||||
D、分别由
|
下列离子方程式中,不正确的是( )
| A、向FeCl2溶液中通入Cl22Fe2++Cl2=2Fe3++2Clˉ |
| B、FeCl3溶液跟过量氨水 Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+ |
| C、碳酸氢钙溶液跟稀硝酸 Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| D、钠与水的反应 2Na+2H2O=2Na++2OH-+H2↑ |
已知反应2NO2(g)+O3(g)?N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图象作出判断正确的是( )
A、 升高温度,平衡常数减小 |
B、 0~3内,反应速率为v(NO2)=0.2mol?L-1 |
C、 t1时仅加入催化剂,平衡正向移动 |
D、 达平衡时,仅改变x,则x为c(O2) |
下列物质的水溶液在蒸发皿中加热蒸干灼烧,能得到原物质的是( )
①NaAlO2 ②FeCl3 ③硫酸铝 ④绿矾 ⑤高锰酸钾 ⑥硝酸银⑦碳酸氢钙 ⑧蛋白质 ⑨Na2SO3 ⑩CaCl2.
①NaAlO2 ②FeCl3 ③硫酸铝 ④绿矾 ⑤高锰酸钾 ⑥硝酸银⑦碳酸氢钙 ⑧蛋白质 ⑨Na2SO3 ⑩CaCl2.
| A、①③⑤⑥⑧⑩ | B、②③④⑤⑨⑩ |
| C、③⑤⑦⑩ | D、①③⑩ |
下列有关环境问题的说法中,不正确的是( )
| A、形成酸雨的主要原因是雨水中溶有CO2 |
| B、氟氯代烷和氮氧化物等会破坏臭氧层 |
| C、CO2、CH4等是造成温室效应的气体 |
| D、白色污染是指废弃塑料制品造成的污染 |
 某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.
某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.