题目内容
已知反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O可用作实验室制氯气,若制得71g Cl2,则
(1)被还原的KMnO4的质量是多少?
(2)被氧化的HCl的质量是多少?
(1)被还原的KMnO4的质量是多少?
(2)被氧化的HCl的质量是多少?
考点:化学方程式的有关计算
专题:计算题
分析:根据化学方程式2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,已知生成的氯气质量,可以计算被还原的KMnO4的质量、氯化氢质量,在方程式中,化合价升高的氯元素所在的反应物氯化氢是被氧化的,化合价降低的元素被还原,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,据此分析解答.
解答:
解:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,则KMnO4为氧化剂,被还原,还原产物为MnCl2;HCl为还原剂,被氧化,Cl2为氧化产物.
(1)Mn元素的化合价由+7价降低为+2价,KMnO4为氧化剂,被还原,设被还原的KMnO4的物质的量为x,则
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2 5
x
解得x=0.4mol,
被还原的KMnO4的质量m=nM=0.4mol×158g/mol=63.2g,
答:被还原的KMnO4的质量是63.2g;
(2)Cl元素的化合价由-1价升高为0,在方程式中,化合价升高的氯元素所在的反应物氯化氢是被氧化,
根据方程式可以看出:在所有反应的盐酸中,被氧化的盐酸和参加反应的盐酸的物质的量之比是10:16=5:8,设参加反应HCl的物质的量为y,
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
16 5
y
解得y=3.2mol,
则被氧化的氯化氢的质量为36.5g/mol×
×3.2mol=73g,
答:被氧化的氯化氢是73克.
(1)Mn元素的化合价由+7价降低为+2价,KMnO4为氧化剂,被还原,设被还原的KMnO4的物质的量为x,则
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2 5
x
| 71g |
| 71g/mol |
解得x=0.4mol,
被还原的KMnO4的质量m=nM=0.4mol×158g/mol=63.2g,
答:被还原的KMnO4的质量是63.2g;
(2)Cl元素的化合价由-1价升高为0,在方程式中,化合价升高的氯元素所在的反应物氯化氢是被氧化,
根据方程式可以看出:在所有反应的盐酸中,被氧化的盐酸和参加反应的盐酸的物质的量之比是10:16=5:8,设参加反应HCl的物质的量为y,
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
16 5
y
| 71g |
| 71g/mol |
解得y=3.2mol,
则被氧化的氯化氢的质量为36.5g/mol×
| 5 |
| 8 |
答:被氧化的氯化氢是73克.
点评:本题考查学生根据化学方程式的计算能力,注意氧化还原反应中,化合价升高元素被氧化,化合价降低元素被还原这一基本知识,题目难度中等.

练习册系列答案
相关题目
已知反应2NO2(g)+O3(g)?N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图象作出判断正确的是( )
A、 升高温度,平衡常数减小 |
B、 0~3内,反应速率为v(NO2)=0.2mol?L-1 |
C、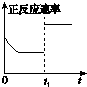 t1时仅加入催化剂,平衡正向移动 |
D、 达平衡时,仅改变x,则x为c(O2) |
下列有关实验的操作和现象描述的对应关系正确的是( )
| A、将NaOH溶液逐滴滴入FeSO4溶液中,只观察到白色沉淀 |
| B、将钠放入水中,钠浮在水面上、熔成一个闪亮的小球、四处游动、溶液变红 |
| C、除去表面保护膜的铝在酒精灯上加热到熔化,熔化的铝以小液滴的形式滴落下来 |
| D、在滴有酚酞溶液的 Na2SiO3溶液中,逐滴加入稀盐酸,溶液的红色逐渐变浅,并有白色胶状物生成 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
| A、1 mol NH5中含有5 NA个N-H键(NA表示阿伏加德罗常数) |
| B、NH5中既有共价键又有离子键 |
C、NH5的电子式为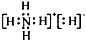 |
| D、它与水反应的离子方程式为NH4++H-+H2O=NH3?H2O+H2↑ |
下列有关环境问题的说法中,不正确的是( )
| A、形成酸雨的主要原因是雨水中溶有CO2 |
| B、氟氯代烷和氮氧化物等会破坏臭氧层 |
| C、CO2、CH4等是造成温室效应的气体 |
| D、白色污染是指废弃塑料制品造成的污染 |
下列做法正确的是( )
| A、金属钠着火时,用大量水进行灭火 |
| B、铝制餐具可代替铁制餐具长时间存放酸性、碱性食物 |
| C、在50mL量筒中配制0.1mol?L-1碳酸钠溶液 |
| D、易燃、易爆药品与有强氧化性的物质要分开放置并远离火源 |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,11.2L乙醇含有的分子数为0.5NA |
| B、常温常压下,22 g CO2含有的原子数为1.5NA |
| C、12 g 金属镁变成镁离子时失去的电子数为0.5NA |
| D、0.1mol?L-1Na2SO4溶液中含有的钠离子数为0.2NA |
