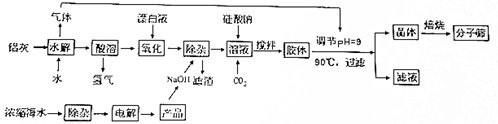
题目内容
14.25℃,0.1mol/L下列物质的溶液中,由水电离出来的c(H+)的大小顺序是⑥>⑤>③>①=④>②①HCl②Ba(OH)③HF ④NaOH ⑤NaCl ⑥Na2CO3.
分析 温度相同时水的离子积常数相同,酸或碱抑制水电离,能水解的盐促进水的电离,根据氢离子浓度或氢氧根离子浓度结合水的离子积常数分析水电离出的氢离子浓度,①HCl是强酸,②Ba(OH)2是强碱,③HF 是弱酸,④NaOH是强碱,酸碱抑制水的电离,水电离出的氢离子减小,⑤NaCl是强酸强碱盐对水的电离无影响,⑥Na2CO3是强碱弱酸盐,溶液中碳酸根离子水解显碱性,促进水的电离.
解答 解:HF是弱电解质,HF溶液中氢离子浓度小于HF浓度,HCl为强酸,完全电离,溶液中氢离子浓度为0.1mol/L,物质的量浓度均为0.1mol/L的酸溶液中,氢离子浓度:③<①=0.1mol/L,氢氧化钠溶液中氢氧根离子浓度=0.1mol/L,氢氧化钡溶液中氢氧根离子浓度=0.2mol/L,酸或碱都抑制水电离,盐酸和氢氧化钠溶液浓度相同,对水的电离抑制程度相同,水电离出氢离子浓度c(H+)<10-7mol/L,液中离子浓度越大,抑制水电离程度越大,氢氧化钡溶液对水的电离抑制程度大,所以由水电离出的c(H+)的大小关系是③>①=④>②,⑤NaCl是强酸强碱盐溶液,溶液呈中性,水电离出的氢离子浓度=10-7mol/L,⑥Na2CO3溶液中碳酸根离子水解溶液显碱性,促进水的电离,水电离出的氢离子浓度c(H+)>10-7mol/L,所以由水电离出来的c(H+)的大小顺序是:⑥>⑤>③>①=④>②,
故答案为:⑥>⑤>③>①=④>②.
点评 本题考查了水电离的影响因素,明确酸和碱抑制水电离、含有弱根离子的盐促进水电离是解本题关键,知道氢离子或氢氧根离子浓度和抑制水电离的关系,难度中等.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案
相关题目
2.下列微粒的物质的量浓度关系正确的是( )
| A. | pH=4的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,c(NH4+)大小顺序为:③>②>① | |
| C. | 等体积,等物质的量浓度的Na2S溶液与NaHS溶液混合后:3c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 等体积、等物质的量浓度的Na2SO3溶液与HCl溶液混合后:c(H+)+c(H2SO3)═c(SO32-)++c(OH-) |
9.下列各组离子能大量共存的是( )
| A. | Na+、Cu2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | B. | H+、K+、HCO${\;}_{3}^{-}$、Ca2+ | ||
| C. | Ba2+、Mg2+、OH-、Cl- | D. | Fe3+、NH${\;}_{4}^{+}$、S2-、Cl- |
12.某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、Fe3+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:

下列结论正确的是( )

下列结论正确的是( )
| A. | X中不能确定的离子是Fe3+、A13+、K+、Na+和C1- | |
| B. | 沉淀G中加入盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| D. | 沉淀I一定是A1(OH)3 |
9.下列装置或操作能达到相应实验目的是( )
| A. |  制备少量氨气 | B. |  海带灼烧成灰 | ||
| C. |  分液时取出下层液体 | D. |  检查气密性 |
10.下列叙述不正确的是( )
| A. | 0.1 mol•L-1氨水中,c(OH-)>c(NH4+) | |
| B. | 等体积等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) | |
| C. | 在0.1 mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 0.1 mol•L-1某二元弱酸强碱盐Na2A溶液中,c(Na+)=2c(A2-)+2c(HA-)+2c(H2A) |