题目内容
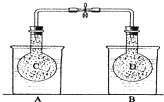 如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:
如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:(1)烧杯A中温度
(2)已知:2NO2(g)?N2O4(g)△H<0,从上面实验可知,D烧瓶内混合气体颜色将
(3)若实验测得B烧杯中酸碱中和反应放热1.4325kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为
(4)若起始时在D烧瓶中充入m g N2O4,此时测得烧瓶中压强为1.01×105Pa,当可逆反应:N2O4(g)?2NO2(g)达到化学平衡状态时压强变为1.515×105Pa(保持温度不变),则平衡时,N2O4的转化率α=
考点:化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)硝酸铵溶解时吸收热量;
(2)酸碱中和时放出热量,导致溶液的温度升高,升高温度平衡向吸热方向移动;
(3)据HCl和NaOH的物质的量,计算生成1mol水时放热多少,再书写热化学方程式;
(4)体积不变的容器中,气体的压强之比等于物质的量之比,求算反应掉的N2O4物质的量,再求算转化率.
(2)酸碱中和时放出热量,导致溶液的温度升高,升高温度平衡向吸热方向移动;
(3)据HCl和NaOH的物质的量,计算生成1mol水时放热多少,再书写热化学方程式;
(4)体积不变的容器中,气体的压强之比等于物质的量之比,求算反应掉的N2O4物质的量,再求算转化率.
解答:
解:(1)硝酸铵溶解时吸收热量导致溶液温度降低,故答案为:降低;
(2)加入氢氧化钠会和盐酸之间发生中和反应时放出热量,导致溶液的温度升高,反应2NO2(g)?N2O4(g)是放热反应,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,故答案为:变深;
(3)n(HCl)=0.50mol/L×0.05L=0.025mol,n(NaOH)=
=0.05mol,0.025molHCl与0.05molNaOH反应,生成0.025mol水时放热1.4325KJ,则生成1mol水时放热57.3KJ,所以热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(2)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O△H=-57.3kJ/mol;
(4)体积不变的容器中,气体的压强之比等于物质的量之比,设反应后的四氧化二氮有nmol,则生成的二氧化氮又2nmol,有
=
,
解得n=
mol,所以α(N2O4)=
×100%=50%,
故答案为:50%.
(2)加入氢氧化钠会和盐酸之间发生中和反应时放出热量,导致溶液的温度升高,反应2NO2(g)?N2O4(g)是放热反应,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,故答案为:变深;
(3)n(HCl)=0.50mol/L×0.05L=0.025mol,n(NaOH)=
| 2g |
| 40g/mol |
故答案为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O△H=-57.3kJ/mol;
(4)体积不变的容器中,气体的压强之比等于物质的量之比,设反应后的四氧化二氮有nmol,则生成的二氧化氮又2nmol,有
| ||
| nmol+2nmol |
| 1.01×105Pa |
| 1.515×105Pa |
解得n=
| m |
| 184 |
| ||
|
故答案为:50%.
点评:本题考查了平衡移动、热化学方程式书写、转化率的求算,题目难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
下列离子方程式书写正确的是( )
A、用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2CH2OH
| ||
| B、过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | ||
| C、向CuSO4溶液中滴加过量的氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ | ||
| D、用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O═NaHCO3↓+NH4+ |
2011年3月15日~18日,中国各地爆发市民抢购食盐“盛况”,谣传“吃碘盐防辐射,日本大地震核泄漏污染海盐.”下列关于NaCl的说法中错误的是( )
A、NaCl的电子式是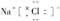 |
| B、炒菜时放入食盐并不破坏NaCl中的化学键 |
| C、加碘食盐中加的是KIO3 |
| D、NaCl溶于水发生电离:NaCl=Na++Cl- |
 磷酸的结构式可用如图表示.磷酸在一定条件下能发生①号键与②′号键的同时断裂:
磷酸的结构式可用如图表示.磷酸在一定条件下能发生①号键与②′号键的同时断裂: