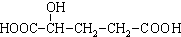题目内容
根据下列条件确定元素在周期表中的位置,并填写下列表格.
(1)基态原子中有3d7;
(2)M3+阳离子和F-阴离子电子层构型相同;
(3)M2+阳离子的3d能级为半充满;
(1)基态原子中有3d7;
(2)M3+阳离子和F-阴离子电子层构型相同;
(3)M2+阳离子的3d能级为半充满;
| 周期数 | 族 | 元素符号或原子序数 | |
| (1) | |||
| (2) | |||
| (3) |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:(1)基态原子中有3d7,根据构造原理知,该基态原子4s能级上还有2个电子,其原子序数为2+8+15+2=27,最大的能级序数等于其周期数,该元素位于第VIII族;
(2)M3+阳离子和F-阴离子电子层构型相同,则M3+阳离子核外有10电子,则M原子核外电子数=10+3=13,原子核外电子数与其原子序数相等,该原子核外有3个电子层、最外层有3个电子,原子电子层数与其周期数相等、最外层电子数与其主族序数相等;
(3)M2+阳离子的3d能级为半充满,则M原子4s能级有2个电子,所以M原子序数=2+8+13+2=25,为副族元素,该元素的最大能级序数等于其周期数.
(2)M3+阳离子和F-阴离子电子层构型相同,则M3+阳离子核外有10电子,则M原子核外电子数=10+3=13,原子核外电子数与其原子序数相等,该原子核外有3个电子层、最外层有3个电子,原子电子层数与其周期数相等、最外层电子数与其主族序数相等;
(3)M2+阳离子的3d能级为半充满,则M原子4s能级有2个电子,所以M原子序数=2+8+13+2=25,为副族元素,该元素的最大能级序数等于其周期数.
解答:
解:(1)基态原子中有3d7,根据构造原理知,该基态原子4s能级上还有2个电子,其原子序数为2+8+15+2=27,最大的能级序数等于其周期数,所以该元素位于第四周期,第VIII族,为Co元素;
(2)M3+阳离子和F-阴离子电子层构型相同,则M3+阳离子核外有10电子,则M原子核外电子数=10+3=13=原子序数,该原子核外有3个电子层、最外层有3个电子,在该元素位于第三周期第IIIA族,为Al元素;
(3)M2+阳离子的3d能级为半充满,则M原子4s能级有2个电子,所以M原子序数=2+8+13+2=25,为副族元素,其周期数是4,为第四周期第VIIB族元素,
故答案为:
(2)M3+阳离子和F-阴离子电子层构型相同,则M3+阳离子核外有10电子,则M原子核外电子数=10+3=13=原子序数,该原子核外有3个电子层、最外层有3个电子,在该元素位于第三周期第IIIA族,为Al元素;
(3)M2+阳离子的3d能级为半充满,则M原子4s能级有2个电子,所以M原子序数=2+8+13+2=25,为副族元素,其周期数是4,为第四周期第VIIB族元素,
故答案为:
| 周期数 | 族 | 元素符号或原子序数 | |
| (1) | 4 | Ⅷ | Co 或27 |
| (2) | 3 | IIIA | Al 或13 |
| (3) | 4 | ⅦB | Mn 或25 |
点评:本题考查元素周期表结构,明确原子结构及元素在周期表中的判断方法是解本题关键,注意副族元素电子排列方式,为易错点.

练习册系列答案
相关题目
根据氧族元素的性质判断,硒不可能具有的性质是( )
| A、非金属性比溴弱 |
| B、H2Se比H2S稳定 |
| C、SeO3对应的水化物是一种酸 |
| D、有-2、+4、+6三种化合价 |
下列叙述正确的是( )
| A、不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度变为原来和的一半 |
| B、5.6 g铁与足量稀硫酸反应失去的电子的物质的量为0.3 mol |
| C、标准状况下,11.2L NO2气体中含氧原子数等于18 g水中含有的氧原子数 |
| D、20 g NaOH溶于1 L水,所得溶液中c(Na+)=0.5 mol/L |

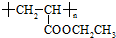 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为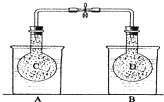 如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:
如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题: )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.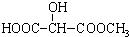 B.
B. C.H3COOC-COOCH3
C.H3COOC-COOCH3 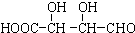 E.
E.