题目内容
某同学用200mL 12mol?L-1浓HCl和足量MnO2缓缓加热来制取Cl2,并将生成的Cl2通入FeBr2溶液和FeI2溶液中来探究Fe2+、Br-和I-的还原性强弱.请回答下列问题:
(1)写出制取Cl2的化学方程式: .
(2)将少量的Cl2通入FeBr2溶液中,溶液由浅绿色变为棕黄色,则该反应的离子方程式为
(3)若将等物质的量的Cl2和FeI2充分反应,再向所得溶液中滴加KSCN溶液,无红色物质生成,则Fe2+、Br-和I-的还原性由强到弱的顺序为 .
(4)若将4.48L(标准状况下)氯气通入800mL碘化亚铁溶液中,充分反应后,测得溶液中Fe2+和Fe3+的物质的量浓度相等,则原碘化亚铁溶液的物质的量浓度为 .
(1)写出制取Cl2的化学方程式:
(2)将少量的Cl2通入FeBr2溶液中,溶液由浅绿色变为棕黄色,则该反应的离子方程式为
(3)若将等物质的量的Cl2和FeI2充分反应,再向所得溶液中滴加KSCN溶液,无红色物质生成,则Fe2+、Br-和I-的还原性由强到弱的顺序为
(4)若将4.48L(标准状况下)氯气通入800mL碘化亚铁溶液中,充分反应后,测得溶液中Fe2+和Fe3+的物质的量浓度相等,则原碘化亚铁溶液的物质的量浓度为
考点:氯气的化学性质,化学方程式的有关计算
专题:计算题,卤族元素
分析:(1)浓盐酸与二氧化锰在加热条件下发生反应生成氯化锰、氯气和水;
(2)二价铁离子还原性强于溴离子,氯气少量,先氧化二价铁离子;
(3)依据氯气与碘离子、二价铁离子反应,结合实验(2)判断离子的还原性的顺序;
(4)碘离子的还原性强于二价铁离子,氯气先氧化碘离子,然后再氧化二价铁离子生成三价铁离子,依据得失电子守恒计算解答.
(2)二价铁离子还原性强于溴离子,氯气少量,先氧化二价铁离子;
(3)依据氯气与碘离子、二价铁离子反应,结合实验(2)判断离子的还原性的顺序;
(4)碘离子的还原性强于二价铁离子,氯气先氧化碘离子,然后再氧化二价铁离子生成三价铁离子,依据得失电子守恒计算解答.
解答:
解:(1)浓盐酸与二氧化锰在加热条件下发生反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)二价铁离子还原性强于溴离子,氯气少量,先氧化二价铁离子,反应的离子方程式为:Cl2+2Fe2+═2Fe3++2Cl-;
故答案为:Cl2+2Fe2+═2Fe3++2Cl-;
(3)将等物质的量的Cl2和FeI2充分反应,再向所得溶液中滴加KSCN溶液,无红色物质生成,说明Cl2氧化I-而未氧化Fe2+,说明I-还原性大于Fe2+,所以Fe2+、Br-和I-的还原性由强到弱的顺序为:I->Fe2+;
通过实验(2)可知还原性:Fe2+>Br-;
故答案为:I->Fe2+>Br-;
(4)碘离子的还原性强于二价铁离子,氯气先氧化碘离子,然后再氧化二价铁离子生成三价铁离子,设FeI2的物质的量为x mol,则氧化I-需用Cl2x mol,氧化Fe2+所用的Cl2为(0.2-x)mol,生成的Fe3+为2(0.2-x)mol,则由溶液中Fe2+和Fe3+的物质的量浓度相等知:
2(0.2-x)=x-2(0.2-x),
解得x=0.16,c=0.16 mol/0.8L=0.2 mol/L;
故答案为:0.2 mol/L.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)二价铁离子还原性强于溴离子,氯气少量,先氧化二价铁离子,反应的离子方程式为:Cl2+2Fe2+═2Fe3++2Cl-;
故答案为:Cl2+2Fe2+═2Fe3++2Cl-;
(3)将等物质的量的Cl2和FeI2充分反应,再向所得溶液中滴加KSCN溶液,无红色物质生成,说明Cl2氧化I-而未氧化Fe2+,说明I-还原性大于Fe2+,所以Fe2+、Br-和I-的还原性由强到弱的顺序为:I->Fe2+;
通过实验(2)可知还原性:Fe2+>Br-;
故答案为:I->Fe2+>Br-;
(4)碘离子的还原性强于二价铁离子,氯气先氧化碘离子,然后再氧化二价铁离子生成三价铁离子,设FeI2的物质的量为x mol,则氧化I-需用Cl2x mol,氧化Fe2+所用的Cl2为(0.2-x)mol,生成的Fe3+为2(0.2-x)mol,则由溶液中Fe2+和Fe3+的物质的量浓度相等知:
2(0.2-x)=x-2(0.2-x),
解得x=0.16,c=0.16 mol/0.8L=0.2 mol/L;
故答案为:0.2 mol/L.
点评:本题考查了卤族元素化合物的知识,题目难度中等,熟悉碘离子、溴离子、二价铁离子还原性强弱顺序为解体关键,易错点为(4),注意得失电子守恒规律的应用.

练习册系列答案
相关题目
A(盐)和B(酸)反应,可放出有气味的气体C,C跟KOH反应又得到A(盐),C氧化的最终产物为W气,W气溶于水又得到B(酸)是( )
| A、K2S和稀H2SO4 |
| B、K2SO3和盐酸 |
| C、K2S和盐酸 |
| D、K2SO3和稀H2SO4 |
有13.5g不纯的CuCl2粉末(内含一种杂质),当它与足量的AgNO3溶液反应时,产生了29gAgCl沉淀,则该粉末中的杂质可能是( )
| A、FeCl3 |
| B、CaCl2 |
| C、ZnCl2 |
| D、BaCl2 |
用来证明棉花和淀粉都是多糖的实验方法是( )
| A、放入氧气中燃烧,检验燃烧产物都是CO2和H2O |
| B、放入银氨溶液中微热,都不发生银镜反应 |
| C、加入浓硫酸后微热,都脱水而变黑 |
| D、分别放入稀酸后煮沸几分钟,用NaOH溶液中和反应后的溶液,再加入新制的Cu(OH)2悬浊液共热,都生成红色沉淀 |

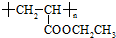 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为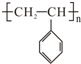 ,试回答下列问题:
,试回答下列问题: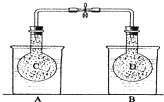 如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:
如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题: