题目内容
设计出燃料电池使天然气CH4氧化直接产生电流是对世纪最富有挑战性的课题之一.最近有人设计了一种燃料电池,一个电极通入空气,另一个电极通入天然气,电池的电解质是掺杂Y2O3的ZrO2晶体.它在高温下能传导O2-,回答如下问题:
(1)这个电池的正极发生的反应是:
(2)负极发生的反应是:
(3)固体电解质里O2-的移动方向是:
(4)天然气燃料电池最大的障碍是氧化反应不完全,产生 堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,这正是新一代化学家的历史使命.
(5)若将此甲烷燃料电池设计成在25%的KOH溶液中的电极反应,该电池的负极区域的碱性会 (填“增强”“减弱”或“不变”)
(1)这个电池的正极发生的反应是:
(2)负极发生的反应是:
(3)固体电解质里O2-的移动方向是:
(4)天然气燃料电池最大的障碍是氧化反应不完全,产生
(5)若将此甲烷燃料电池设计成在25%的KOH溶液中的电极反应,该电池的负极区域的碱性会
考点:化学电源新型电池
专题:电化学专题
分析:(1)该燃料电池中,正极上仪器得电子生成氧离子;
(2)负极上甲烷失电子和氧离子反应生成二氧化碳和水;
(3)放电时,电解质中阴离子向负极移动;
(4)天然气如果被氧化不完全,则生成固体碳而阻塞电极气体通道;
(5)甲烷燃料碱性电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水.
(2)负极上甲烷失电子和氧离子反应生成二氧化碳和水;
(3)放电时,电解质中阴离子向负极移动;
(4)天然气如果被氧化不完全,则生成固体碳而阻塞电极气体通道;
(5)甲烷燃料碱性电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水.
解答:
解:(1)该燃料电池中,正极上仪器得电子生成氧离子,电极反应式为O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
(2)负极上甲烷失电子和氧离子反应生成二氧化碳和水,电极反应式为CH4-8e-+4O2-=CO2+2H2O,故答案为:CH4-8e-+4O2-=CO2+2H2O;
(3)放电时,电解质中阴离子向负极移动、阳离子向正极移动,所以氧离子向负极移动,故答案为:由正极移向负极;
(4)天然气如果被氧化不完全,则生成固体碳而阻塞电极气体通道,故答案为:C;
(5)甲烷燃料碱性电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,负极反应式为CH4+10OH--8e-=CO32-+7H2O,有氢氧根离子参加反应导致溶液碱性减弱,故答案为:减弱.
(2)负极上甲烷失电子和氧离子反应生成二氧化碳和水,电极反应式为CH4-8e-+4O2-=CO2+2H2O,故答案为:CH4-8e-+4O2-=CO2+2H2O;
(3)放电时,电解质中阴离子向负极移动、阳离子向正极移动,所以氧离子向负极移动,故答案为:由正极移向负极;
(4)天然气如果被氧化不完全,则生成固体碳而阻塞电极气体通道,故答案为:C;
(5)甲烷燃料碱性电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,负极反应式为CH4+10OH--8e-=CO32-+7H2O,有氢氧根离子参加反应导致溶液碱性减弱,故答案为:减弱.
点评:本题考查化学电源新型电池,明确原电池原理是解本题关键,侧重考查学生书写电极反应式,书写时要结合电解质特点书写,燃料和氧化剂相同,如果电解质不同其电极反应式不同.

练习册系列答案
相关题目
在化学反应Cu+2H2SO4(浓)═CuSO4+SO2↑+H2O中,氧化剂是( )
| A、Cu |
| B、H2SO4 |
| C、CuSO4 |
| D、SO2 |
 ,试回答下列问题:
,试回答下列问题: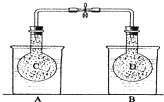 如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:
如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题: