题目内容
高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+.已知制取高铁酸钠的化学方程式为:2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O,回答下列问题:
(1)该反应中还原剂是 ,Na2FeO4中Fe的化合价为 价,是 产物,每生成1mol Na2FeO4反应中转移电子的物质的量为 .
(2)用单线桥法表示电子转移的方向和数目(在方程式上标明)
(3)Na2FeO4之所以能净水,一个是利用其 性能消毒杀菌,另一个净水的理由是 .
(1)该反应中还原剂是
(2)用单线桥法表示电子转移的方向和数目(在方程式上标明)
(3)Na2FeO4之所以能净水,一个是利用其
考点:氧化还原反应的电子转移数目计算,氧化还原反应
专题:氧化还原反应专题
分析:(1)氧化还原反应中,化合价升高元素在反应中被氧化,化合价降低元素在反应中被还原,得到还原产物,化合价降低值=化合价升高值=转移电子数,据此回答;
(2)反应中,铁元素化合价升高,失电子,Cl元素化合价降低,得到电子,化合价降低值=化合价升高值=转移电子数,据此回答;
(3)在反应中Na2FeO4被还原为Fe3+离子,Fe3+水解得到的氢氧化铁胶体具有吸附性.
(2)反应中,铁元素化合价升高,失电子,Cl元素化合价降低,得到电子,化合价降低值=化合价升高值=转移电子数,据此回答;
(3)在反应中Na2FeO4被还原为Fe3+离子,Fe3+水解得到的氢氧化铁胶体具有吸附性.
解答:
解:(1)反应2Fe(NO3)3+16NaOH+3Cl2═2Na2FeO4+6NaNO3+6NaCl+8H2O中,Fe元素化合价升高,硝酸铁是还原剂,根据化合价规则,Na2FeO4中Fe是+6价,在反应中Na2FeO4是氧化产物,该反应中,化合价降低值=化合价升高值=转移电子数=6,所以每生成1mol Na2FeO4反应中转移电子的物质的量为3mol,故答案为:Fe(NO3)3;+6;氧化;3mol;
(2)反应中,铁元素化合价升高,失电子,Cl元素化合价降低,得到电子,化合价降低值=化合价升高值=转移电子数=6,电子转移情况如下: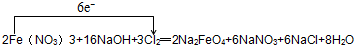 ,故答案为:
,故答案为: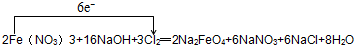 ;
;
(3)Na2FeO4中铁元素师+6价,具有强氧化性,能杀菌消毒,在反应中Na2FeO4被还原为Fe3+离子,Fe3+水解得到的氢氧化铁胶体具有吸附性,Fe3++3H2O?Fe(OH)3+3H+,氢氧化铁胶体具有吸附性,以用于净水,
故答案为:强氧化 FeO4被还原成Fe3+,Fe3+水解生成Fe(OH)3胶体,具有很强的吸附作用,能吸附杂质而沉降下来达到净水.
(2)反应中,铁元素化合价升高,失电子,Cl元素化合价降低,得到电子,化合价降低值=化合价升高值=转移电子数=6,电子转移情况如下:
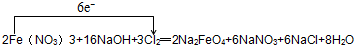 ,故答案为:
,故答案为: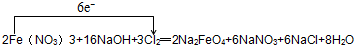 ;
;(3)Na2FeO4中铁元素师+6价,具有强氧化性,能杀菌消毒,在反应中Na2FeO4被还原为Fe3+离子,Fe3+水解得到的氢氧化铁胶体具有吸附性,Fe3++3H2O?Fe(OH)3+3H+,氢氧化铁胶体具有吸附性,以用于净水,
故答案为:强氧化 FeO4被还原成Fe3+,Fe3+水解生成Fe(OH)3胶体,具有很强的吸附作用,能吸附杂质而沉降下来达到净水.
点评:本题考查学生氧化还原反应中电子的转移和氧化还原反应中的基本概念知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
瓦斯爆炸是空气中含甲烷5%~15.4%(体积分数)遇火所产生的,发生爆炸最强烈时,甲烷在空气中的体积分数大约为( )
| A、10.5% | B、9.5% |
| C、8% | D、5% |
根据氧族元素的性质判断,硒不可能具有的性质是( )
| A、非金属性比溴弱 |
| B、H2Se比H2S稳定 |
| C、SeO3对应的水化物是一种酸 |
| D、有-2、+4、+6三种化合价 |
有13.5g不纯的CuCl2粉末(内含一种杂质),当它与足量的AgNO3溶液反应时,产生了29gAgCl沉淀,则该粉末中的杂质可能是( )
| A、FeCl3 |
| B、CaCl2 |
| C、ZnCl2 |
| D、BaCl2 |
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且
的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||
| B、参加反应的氯气的物质的量等于3a mol | ||||||
| C、改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol | ||||||
| D、改变温度,产物中KClO3的最大理论产量为a mol |

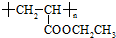 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为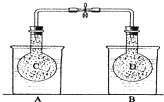 如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:
如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题: