题目内容
8.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是( )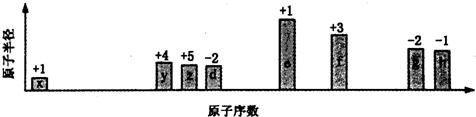
| A. | 离子半径的大小顺序:e>f>g>h | |
| B. | 与x形成简单化合物的沸点:y>z>d | |
| C. | x、z、d三种元素形成的化合物可能含有离子键 | |
| D. | e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应 |
分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
A.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
B.常温下,水为液体,甲烷、氨气为气体,水的沸点最高,氨气分子之间存在氢键,沸点比甲烷的高;
C.x、z、d三种元素形成可以形成硝酸铵;
D.e、f、g、h四种元素对应最高价氧化物的水化物分别为NaOH、Al(OH)3、硫酸、高氯酸,硫酸与高氯酸不反应.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
A.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->Cl->Na+>Al3+,故A错误;
B.常温下,水为液体,甲烷、氨气为气体,水的沸点最高,氨气分子之间存在氢键,沸点高于甲烷的,故B错误;
C.x、z、d三种元素形成可以形成硝酸铵,属于离子化合物,故C正确;
D.e、f、g、h四种元素对应最高价氧化物的水化物分别为NaOH、Al(OH)3、硫酸、高氯酸,氢氧化铝属于两性氢氧化物,能与强酸、强碱反应,氢氧化钠能与酸反应,但硫酸与高氯酸之间不反应,故D错误,
故选:C.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
7.某烯烃CH3CH=C(CH3)2是卤代烷消去而生成,则该卤代烷的结构有( )
| A. | 一种 | B. | 二种 | C. | 三种 | D. | 四种 |
19.为了说明盐类水解是吸热反应,常温下,现用醋酸钠进行实验,表明它在水解时是吸热反应,其中的实验方案正确的是( )
| A. | CH3COONa溶液中含有少量的CH3COOH | |
| B. | 醋酸钠溶液的pH大于7 | |
| C. | 醋酸钠溶液中滴入酚酞显红色,加热后颜色变深 | |
| D. | 醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气 |
16.下列实验设计能完成或实验结论合理的是( )
| A. | 证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 | |
| B. | 铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含Fe2O3 | |
| C. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 | |
| D. | 检验Cu2+和Fe3+离子,采用径向纸层析法,待离子在滤纸上展开后,用浓氨水熏,可以检验出Cu2+ |
20.化学与人类生产、生活密切相关,下列有关说法错误的是( )
| A. | 可向海水中加入明矾使海水淡化从而解决淡水供应危机 | |
| B. | 福尔马林可用于浸制标本,是因为其能使蛋白质变性 | |
| C. | 应用酒精的浓度通常为75% | |
| D. | 向烟花中添加含钠、钙、铜等金属元素的化合物可在燃烧时产生绚丽缤纷的效果 |
18.下列说法正确的是( )
| A. | 1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L | |
| B. | 从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液中氢离子的浓度为2 mol/L | |
| C. | 配制480 mL 0.5 mol/L的CuSO4溶液,需称取62.5 g胆矾 | |
| D. | 中和100 mL 1mol/L的H2SO4溶液,需NaOH为4 g |
