题目内容
12.能正确表示下列反应的离子方程式是( )| A. | NH4HCO3溶液中加入足量NaOH溶液共热:NH+4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 过量的铁与浓硝酸反应:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O | |
| C. | 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | 用食醋溶解水垢:CaCO3+2H+═Ca2++CO2↑+H2O Mg(OH)2+2H+═Mg2++2H2O |
分析 A.漏掉碳酸氢根离子与氢氧根离子的反应;
B.铁过量反应生成二价铁离子;
C.过氧化氢具有强的氧化性,能够氧化二价铁离子生成三价铁离子;
D.醋酸为弱酸应保留化学式.
解答 解:A.二者反应生成碳酸钠、氨气和水,离子方程式为NH4++2OH-+HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O,故A错误;
B.过量的铁与浓硝酸反应,离子方程式:Fe+4H++2NO3-═Fe2++2NO2↑+2H2O,故B错误;
C.硫酸亚铁酸性溶液中加入过氧化氢,离子方程式:2Fe2++H2O2+2H+═2Fe3++2H2O,故C正确;
D.用食醋溶解水垢,离子方程式:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,Mg(OH)2+2CH3COOH═Mg2++2H2O+2CH3COO-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写方法,题目难度中等,注意掌握离子方程式的书写原则,注意化学式拆分,反应物用量对反应的影响,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
20.化学与人类生产、生活密切相关,下列有关说法错误的是( )
| A. | 可向海水中加入明矾使海水淡化从而解决淡水供应危机 | |
| B. | 福尔马林可用于浸制标本,是因为其能使蛋白质变性 | |
| C. | 应用酒精的浓度通常为75% | |
| D. | 向烟花中添加含钠、钙、铜等金属元素的化合物可在燃烧时产生绚丽缤纷的效果 |
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2 mol SO3含有的氧原子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32-)=1 mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中Na+的浓度为1 mol/L |
4.某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.
(1)[提出假设]向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:反应后固体中固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化.
(2)[定性研究]
为验证假设三是否成立,兴趣小组进行如下研究,请你完成下表中内容
(3)[定量研究]通过测量气体的体积判断发生的化学反应,实验装置如下:
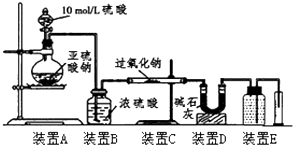
①装置D的作用是吸收未反应的SO2.
②实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据进行判断
(1)[提出假设]向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:反应后固体中固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化.
(2)[定性研究]
为验证假设三是否成立,兴趣小组进行如下研究,请你完成下表中内容
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,… |

①装置D的作用是吸收未反应的SO2.
②实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据进行判断
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | 0<V<$\frac{7{m}_{1}}{30}$或m1>$\frac{30V}{7}$ |
| 未被氧化 | V=$\frac{7{m}_{1}}{30}$或m1=$\frac{30V}{7}$ |
1.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 氯化氢的摩尔质量为36.5 g/mol,O2的摩尔质量为16g/mol | |
| B. | 常温下,2.7克铝与足量的盐酸反应,失去的电子数为0.3 NA | |
| C. | 标准状况下,0.3molSO2中含氧原子数为0.3NA | |
| D. | 标准状况下,11.2 L CCl4中含氯原子数为2 NA |
2.社会实践活动中,课外兴趣小组对某钢铁厂的铁矿石样品和钢样进行实验、分析、计算,了解了该钢铁厂生产原料、产品的相关信息.下面请你根据他们的实验帮助计算回答:
取该厂的某钢样粉末28.36g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3g白色沉淀.
(1)计算此钢样粉末中铁和碳的质量之比.
(2)再取三份不同质量的钢样粉末分别加到50 g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2g H2的体积为22.4 L)
请根据表中数据计算硫酸中H2SO4的质量分数.
(3)若在实验Ⅱ中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
取该厂的某钢样粉末28.36g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3g白色沉淀.
(1)计算此钢样粉末中铁和碳的质量之比.
(2)再取三份不同质量的钢样粉末分别加到50 g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2g H2的体积为22.4 L)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.836 | 5.672 | 8.508 |
| 生成气体的体积(标准状况)/L | 1.12 | 2.24 | 2.80 |
(3)若在实验Ⅱ中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
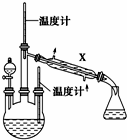 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl