题目内容
8.已知CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-Q1kJ•mol-1,2H2(g)+O2(g)=2H2O(g);△H2=-Q2 kJ•mol-1,2H2(g)+O2(g)=2H2O(l);△H2=-Q3 kJ•mol-1.常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为0.4Q1+0.1Q3kJ.
分析 根据混合气体的体积计算混合气体的物质的量,结合气体体积比计算甲烷、氢气的物质的量,再根据热化学反应方程式计算放出的热量.注意燃烧后恢复至常温,氢气燃烧放出的热量应选择生成液态水的热化学反应方程式计算.
解答 解:甲烷和氢气的混合气体11.2L(已折合成标准状况),
所以甲烷和氢气的混合气体的总的物质的量为n=$\frac{11.2L}{22.4L/mol}$=0.5mol,
甲烷和氢气的体积比为4:1,所以甲烷的物质的量为0.5mol×$\frac{4}{5}$=0.4mol,氢气的物质的量为0.5mol-0.4mol=0.1mol.
由CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-Q1kJ•mol-1可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1kJ/mol=0.4Q1kJ;
由2H2(g)+O2(g)=2H2O(l);△H2=-Q3 kJ•mol-1,可知,0.1mol氢气燃烧生成液态水放出的热量为0.1mol×Q3kJ/mol=0.1Q3kJ.
所以放出的热量为0.4Q1+0.1Q3.
故答案为:0.4Q1+0.1Q3kJ.
点评 本题考查根据热化学方程式进行的有关反应热的计算,难度不大,理解热化学方程式的意义是关键,注意室温下水为液体.

练习册系列答案
相关题目
19.(1)已知25℃时有关弱酸的电离平衡常数:
①同温度下,等pH值的NaHCO3、NaCN、Na2CO3溶液的物质的量浓度由大到小的顺序为NaHCO3>NaCN>Na2CO3.
②若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数.
(2)上述提供的同浓度酸中,酸性最强的是HSCN;酸性最弱的是HCO3-;若向NaCN溶液中通入少量的CO2,发生反应的离子方程式CN-+H2O+CO2=HCN+HCO3-.
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3.Na2CO3俗称纯碱,该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+);同浓度的碳酸钠溶液和碳酸氢钠溶液pH较大的是Na2CO3.
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数.
(2)上述提供的同浓度酸中,酸性最强的是HSCN;酸性最弱的是HCO3-;若向NaCN溶液中通入少量的CO2,发生反应的离子方程式CN-+H2O+CO2=HCN+HCO3-.
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3.Na2CO3俗称纯碱,该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+);同浓度的碳酸钠溶液和碳酸氢钠溶液pH较大的是Na2CO3.
1.乙苯是一种用途广泛的有机原料,可制备多种化工产品.
(一)制备苯乙烯(原理如反应I所示):
Ⅰ、 ?
? (g)+H2(g)△H=+124kJ•mol-1
(g)+H2(g)△H=+124kJ•mol-1
(1)部分化学键的键能如下表所示:
根据反应I的能量变化,计算x=612.
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学一平衡理论解释通入水蒸气的原因为正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)从体系自由能变化的角度分析,反应I在高温(填“高温”或“低温”)下有利于其自发进行.
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ、 +Cl2(g)?
+Cl2(g)? +HCl(g)△H2>0
+HCl(g)△H2>0
(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯或Cl2、α-氯乙基苯或HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:

①0-5min内,以HCl表示的该反应速率v(HCl)=0.032mol•L-1•min-1.
②T℃时,该反应的平衡常数K=16.
③6min时,改变的外界条件为升高温度.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12min,Cl2和HC1的浓度变化曲线(曲线上标明Cl2和HC1);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2表示,则αl<α2(填“>”、“<”或“=”).
(一)制备苯乙烯(原理如反应I所示):
Ⅰ、
 ?
? (g)+H2(g)△H=+124kJ•mol-1
(g)+H2(g)△H=+124kJ•mol-1(1)部分化学键的键能如下表所示:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学一平衡理论解释通入水蒸气的原因为正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)从体系自由能变化的角度分析,反应I在高温(填“高温”或“低温”)下有利于其自发进行.
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ、
 +Cl2(g)?
+Cl2(g)? +HCl(g)△H2>0
+HCl(g)△H2>0(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯或Cl2、α-氯乙基苯或HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:

①0-5min内,以HCl表示的该反应速率v(HCl)=0.032mol•L-1•min-1.
②T℃时,该反应的平衡常数K=16.
③6min时,改变的外界条件为升高温度.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12min,Cl2和HC1的浓度变化曲线(曲线上标明Cl2和HC1);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2表示,则αl<α2(填“>”、“<”或“=”).
5.Na2SO3的氧化反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)△H=m kJ•mol-1.其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段.
(1)已知O2(g)?O2(aq)△H=nkJ•mol-1,Na2SO3溶液与O2(g)反应的热化学方程式为2Na2SO3(aq)+O2(g)=2Na2SO4(aq)△H=(m+n)kJ•mol-1
(2)291.5K时,1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mg•L-1,每5s记录溶解氧浓度,实验结果如图.当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mg•L-1,则0-20s内Na2SO3的平均反应速率为1.00×10-5mol•L-1•s-1
(3)为确定贫氧区速率方程v=kca(SO32-)•cb(O2)中a,b的值(取整数),分析实验数据.
①当溶解氧浓度为4.0mg•L-1时,c(Na2SO3)与速率数值关系如表,则a=2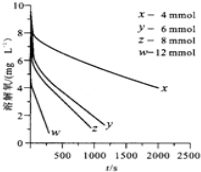
②当溶解氧浓度小于4.0mg•L-1时,图中曲线皆为直线,则b=0,
(4)两个阶段不同温度的速率常数(k)之比如表.
已知ln$\frac{{k}_{2}}{{k}_{1}}$=-$\frac{{E}_{a}}{R}$($\frac{1}{{T}_{2}}-\frac{1}{{T}_{1}}$),R为常数,Ea(富氧区)<Ea(贫氧区)(填“>”或“<”).
(5)结合图表分析,Na2SO3初始量不同时,划分富氧区与贫氧区的溶解氧浓度是否相同,为什么?.
(6)一定温度下,化学反应速率仅与决速步的反应物浓度有关.Na2SO3氧化反应历程涉及的
①SO32-+O2→SO5-
②SO5-+SO32-→SO52-+SO3-
③SO32-+SO32-→SO3-+SO32-
④SO32-+O2→SO5-
⑤SO52-+SO32-→2SO42-
富氧区与和贫氧区的决速步分别是①、③(填序号)
(1)已知O2(g)?O2(aq)△H=nkJ•mol-1,Na2SO3溶液与O2(g)反应的热化学方程式为2Na2SO3(aq)+O2(g)=2Na2SO4(aq)△H=(m+n)kJ•mol-1
(2)291.5K时,1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mg•L-1,每5s记录溶解氧浓度,实验结果如图.当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mg•L-1,则0-20s内Na2SO3的平均反应速率为1.00×10-5mol•L-1•s-1
(3)为确定贫氧区速率方程v=kca(SO32-)•cb(O2)中a,b的值(取整数),分析实验数据.
| c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| v×106 | 10.2 | 24.4 | 44.7 | 103.6 |

②当溶解氧浓度小于4.0mg•L-1时,图中曲线皆为直线,则b=0,
(4)两个阶段不同温度的速率常数(k)之比如表.
| 反应阶段 | 速率方程 | $\frac{k(297.0K)}{k(291.5K)}$ |
| 富氧区 | v=kc(SO32-)•c(O2) | 1.47 |
| 贫氧区 | v=kca(SO32-)•cb(O2) | 2.59 |
(5)结合图表分析,Na2SO3初始量不同时,划分富氧区与贫氧区的溶解氧浓度是否相同,为什么?.
(6)一定温度下,化学反应速率仅与决速步的反应物浓度有关.Na2SO3氧化反应历程涉及的
①SO32-+O2→SO5-
②SO5-+SO32-→SO52-+SO3-
③SO32-+SO32-→SO3-+SO32-
④SO32-+O2→SO5-
⑤SO52-+SO32-→2SO42-
富氧区与和贫氧区的决速步分别是①、③(填序号)
6.实验室从含氯化钠、硝酸钾混合液中提取KNO3的过程如图所示.下列分析正确的是( )


| 选项 | 操作1 | 操作2 | 操作3 | 操作4 |
| A | 溶解 | 结晶 | 蒸发 | 过滤 |
| B | 蒸发 | 过滤 | 冷却 | 过滤 |
| C | 蒸发 | 结晶 | 结晶 | 蒸发 |
| D | 过滤 | 结晶 | 冷却 | 结晶 |
| A. | A | B. | B | C. | C | D. | D |
 (1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H
(1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H