题目内容
16.如图1是某研究性学习小组设计制取氯气并以氯气为原料进行特定反应的装置.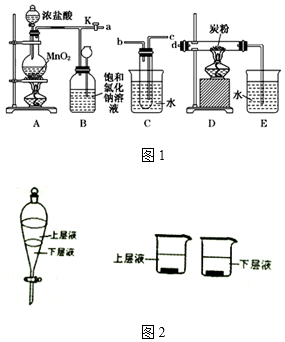
(1)要将C装置接入B和D之间,正确的接法是:a→c→b→d;
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯,Cl2通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2.
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是瓶中液面下降,长颈漏斗内液面上升,B的作用是贮存少量Cl2,避免Cl2对环境造成污染.
(4)用量筒量取20mL E中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10mL CCl4,盖好玻璃塞,振荡,静置于铁架台上(如图2),等分层后取上层液和下层液,能使有色布条褪色的是上层液(填“上层液”或“下层液”).
分析 (1)试管中盛有水,气体通过盛有水的试管时应采用长进短出的方式;
(2)根据题干信息判断反应物和生成物,然后结合质量守恒定律书写化学方程式;
(3)关闭旋塞K,B中的气体逐渐增多,压强增大,B能贮存气体;
(4)应用相似相溶原理,结合萃取操作方法进行解答.
解答 解:(1)由装置图判断判断,气体由B流经C进入到D中反应,气体通过盛有水的试管时应长进短出,否则不能通过C装置,
故答案为:c;b;
(2)由题意知C为提供水蒸气的装置,加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,反应为Cl2、C、H2O,生成物为HCl和CO2,则反应的化学方程式为:2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2,
故答案为:2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2;
(3)关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,B中的气体逐渐增多,压强增大,则导致瓶中液面下降,长颈漏斗内液面上升;氯气有毒,不能直接排放到空气中,B具有贮存少量氯气,并能防止空气污染,
故答案为:瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2,避免Cl2对环境造成污染;
(4)应用相似相溶原理,氯气在CCl4中溶解度较大,而且四氯化碳的密度比水大,呈黄绿色的是溶有氯气的下层四氯化碳层,能使有色布条褪色,氯气在无机层与接触发生化学反应生成次氯酸,而导致有色布条褪色的,
故答案是:上层液.
点评 本题考查氯气的制备、氯气的化学性质,题目难度中等,涉及萃取的操作方法、次氯酸的漂白原理和防倒吸的相关知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.

| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定气态氢化物是HF;
(4)在B、C、F、H中,离子半径从大到小的顺序是S2->Cl->Na+>Al3+;
(5)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.

| A. | t1时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂 | |
| B. | 反应达到平衡时,外界条件对平衡影响关系如图所示,若b=1,a为正整数,则P1<P2 | |
| C. | 从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A、B一定是气体,D一定不是气体,C可能不是气体 |

| A. | 可用NaOH和湿润的红色的石蕊试纸检验NH4+ | |
| B. | 该方法会导致水体pH下降 | |
| C. | 该方法中O2做氧化剂,微生物做还原剂 | |
| D. | 处理后的废水需进一步处理才能排放 |


 )的废水可以通过构成微生物电池除去,其原理如图5所示.
)的废水可以通过构成微生物电池除去,其原理如图5所示.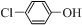 +2e-+H+═
+2e-+H+═ -OH+Cl-.
-OH+Cl-.