题目内容
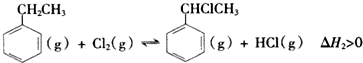
1.乙苯是一种用途广泛的有机原料,可制备多种化工产品.(一)制备苯乙烯(原理如反应I所示):
Ⅰ、
 ?
? (g)+H2(g)△H=+124kJ•mol-1
(g)+H2(g)△H=+124kJ•mol-1(1)部分化学键的键能如下表所示:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学一平衡理论解释通入水蒸气的原因为正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)从体系自由能变化的角度分析,反应I在高温(填“高温”或“低温”)下有利于其自发进行.
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ、
 +Cl2(g)?
+Cl2(g)? +HCl(g)△H2>0
+HCl(g)△H2>0(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯或Cl2、α-氯乙基苯或HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:

①0-5min内,以HCl表示的该反应速率v(HCl)=0.032mol•L-1•min-1.
②T℃时,该反应的平衡常数K=16.
③6min时,改变的外界条件为升高温度.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12min,Cl2和HC1的浓度变化曲线(曲线上标明Cl2和HC1);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2表示,则αl<α2(填“>”、“<”或“=”).
分析 (1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差;
(2)保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
(3)G=△H-T△S,△G为自由能变化,△H为焓变,T为热力学温度,△S熵变.当△G<0时反应能自发进行,△G>0时反应不能自发进行,据此分析判断;
(4)①根据v=$\frac{\frac{△n}{V}}{△t}$计算;
②化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,利用三段式计算平衡常数;
③6min时,反应向正反应方向移动;根据影响平衡移动的条件可知,改变的外界条件为升高温度;
④10min时,计算平衡常数,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,相当于增加反应物的浓度,平衡正向移动,12min时达到新平衡,平衡常数不变,利用三段式计算并画图.
解答 解:(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,设C=C键能为X,则△H=(5×412+348-3×412-X-436)kJ•mol-1=124kJ•mol-1,解得X=612KJ/mol;
故答案为:612KJ/mol;
(2)降低压强,平衡向体积增大的方向移动,制备苯乙烯的正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
故答案为:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
(3)反应自发进行需要满足,△H-T△S<0,依据题干条件可知,制备苯乙烯的正反应为气体分子数增大的反应,△S>0,正反应吸热,△H=+124KJ/mol>0,所以反应一定是在高温条件下才能自发进行,
故答案为:高温;
(4)①T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,依据题干条件可知,C(HCl)=0.16mol/L,v=$\frac{\frac{△n}{V}}{△t}$=$\frac{0.16mol/L}{5min}$=0.032 mol•L-1•min-1,
故答案为:0.032 mol•L-1•min-1;
②5min时达到平衡,依据题干条件可知,C(HCl)=0.16mol/L,n(HCl)=1.6mol,
起始(mol) 2 2 0 0
转化(mol) 1.6 1.6 1.6 1.6
平衡(mol) 0.4 0.4 1.6 1.6
平衡常数为K=$\frac{\frac{1.6}{10}×\frac{1.6}{10}}{\frac{0.4}{10}×\frac{0.4}{10}}$=16,
故答案为:16;
③制备α-氯乙基苯的正反应为吸热反应,反应前后气体的体积不变,6min时,乙苯、Cl2的浓度在减小,而α-氯乙基苯和HCl的浓度在增加,反应向正反应方向移动,只能是升高温度,
故答案为:升高温度;
④10min时,乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度分别为:0.02mol/L、0.02mol/L、0.18mol/L、0.18mol/L,平衡常数为K=$\frac{0.18×0.18}{0.02×0.02}$=81,此时乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度比为:1:1:9:9,保持其他条件不变,再向容器中充人1mol 乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,相当于增加反应物的浓度,平衡正向移动,则α1<α2,设转化的乙苯物质的量浓度为x,
则
起始(mol/L) 0.12 0.12 0.28 0.28
转化(mol/L) x x x x
平衡(mol/L) 0.12-x 0.12-x 0.28+x 0.28+x
平衡常数为K=$\frac{(0.28+x)×(0.28+x)}{(0.12-x)×(0.12-x)}$=81,
解得x=0.08mol/L,则12min时,乙苯、Cl2物质的量浓度都为0.12-x=0.04mol/L,α-氯乙基苯和 HCl的物质的量浓度都为:0.28+x=0.36mol/L,浓度变化曲线如图: ,
,
故答案为: ;<.
;<.
点评 本题考查了反应热的计算、化学平衡理论,明确应热=反应物总键能-生成物总能键能,熟悉影响化学平衡移动的因素是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用小苏打 (NaHCO3)治疗胃酸过多:HCO3-+H+═H2O+CO2↑ | |
| C. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |

| A. | t1时改变某一条件有如图所示变化,则改变的条件一定是加入催化剂 | |
| B. | 反应达到平衡时,外界条件对平衡影响关系如图所示,若b=1,a为正整数,则P1<P2 | |
| C. | 从加入反应物开始,物质的百分含量与温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 反应速率和反应条件变化如图所示,则该反应正反应为放热反应,A、B一定是气体,D一定不是气体,C可能不是气体 |
 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂B.降低反应体系的温度
C.充入氩气使容器内压强增大D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO完全燃烧的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-284kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
(5)O3可由电解稀硫酸制得,原理如右图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
| A. | 标准状况下,2.24 L水中含有的分子数约为0.l NA | |
| B. | 在常温常压下,1 mol He含有的原子数为NA | |
| C. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5mol/L FeCl3溶液中Cl-的数目为1.5NA |
| A. | Fe3+ | B. | Al3+ | C. | NH4+ | D. | Cl- |


 )的废水可以通过构成微生物电池除去,其原理如图5所示.
)的废水可以通过构成微生物电池除去,其原理如图5所示.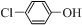 +2e-+H+═
+2e-+H+═ -OH+Cl-.
-OH+Cl-.