题目内容
已知标准状况下:①6.72L CH4②3.01×1023HCl ③23.1g CCl4④2.3g Na,下列对四种物质的关系由小到大表示正确的是( )
| A、体积 ④<①<②<③ |
| B、密度 ①<④<③<② |
| C、原子数 ④<③<②<① |
| D、质量 ④<①<③<② |
考点:阿伏加德罗定律及推论
专题:
分析:标况下,气体摩尔体积相等,①6.72L CH4的物质的量=
=0.3mol,②3.01×1023HCl
=0.5mol ③23.1g CCl4的物质的量=
=0.15mol,④2.3g Na的物质的量=
=0.1mol,根据V=nVm、ρ=
、N=nNA结合分子构成、m=nM进行计算.
| 6.72L |
| 22.4L/mol |
| 3.01×1023 |
| 6.02×1023/mol |
| 23.1g |
| 154g/mol |
| 2.3g |
| 23g/mol |
| M |
| Vm |
解答:
解:标况下,气体摩尔体积相等,①6.72L CH4的物质的量=
=0.3mol,②3.01×1023HCl
=0.5mol ③23.1g CCl4的物质的量=
=0.15mol,④2.3g Na的物质的量=
=0.1mol,
A.根据V=nVm知,相同条件下,气体体积之比等于物质的量之比,所以其体积顺序是④<③<①<②,故A错误;
B.ρ=
知,相同条件下,气体密度之比等于其摩尔质量之比,所以其密度顺序是①<④<②<③,故B错误;
C.根据N=nNA知,其分子数之比等于物质的量之比,分子数大小顺序是④<③<①<②,根据分子构成其原子个数大小顺序是,故C正确;
D.甲烷质量=0.3mol×16g/mol=4.8g,HCl质量=0.5mol×36.5g/mol=18.25g,四氯化碳质量为23.1g,钠的质量是2.3g,所以其质量顺序是④<①<②<③,故D错误;
故选C.
| 6.72L |
| 22.4L/mol |
| 3.01×1023 |
| 6.02×1023/mol |
| 23.1g |
| 154g/mol |
| 2.3g |
| 23g/mol |
A.根据V=nVm知,相同条件下,气体体积之比等于物质的量之比,所以其体积顺序是④<③<①<②,故A错误;
B.ρ=
| M |
| Vm |
C.根据N=nNA知,其分子数之比等于物质的量之比,分子数大小顺序是④<③<①<②,根据分子构成其原子个数大小顺序是,故C正确;
D.甲烷质量=0.3mol×16g/mol=4.8g,HCl质量=0.5mol×36.5g/mol=18.25g,四氯化碳质量为23.1g,钠的质量是2.3g,所以其质量顺序是④<①<②<③,故D错误;
故选C.
点评:本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,熟练掌握物质的量公式,题目难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
观察如图装置,下列说法正确的是( )
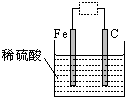

| A、虚线框中接灵敏电流计,铁被腐蚀,并能将电能转化为化学能 |
| B、虚线框中保持断开状态,铁可能不会被腐蚀 |
| C、虚线框中接直流电源,铁可能不会被腐蚀 |
| D、虚线框中无论接灵敏电流计还是直流电源,铁都会加快腐蚀 |
下列说法正确的是( )
| A、需要加热的化学反应都是吸热反应 |
| B、水力发电是将化学能转化为电能的过程 |
| C、某吸热反应能自发进行,因此该反应是熵增反应 |
| D、原电池是将电能转化为化学能的一种装置 |
将12mol/L的盐酸(ρ=1.19g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为( )
| A、50mL |
| B、50.5mL |
| C、55mL |
| D、59.5mL |
下列反应既属于离子反应,又属于氧化还原反应的放热反应是( )
| A、铝片与稀盐酸反应 |
| B、灼热的碳与CO2反应 |
| C、Ba(OH)2?8H2O与NH4Cl固体反应 |
| D、甲烷在氧气中的燃烧反应 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2L氧气所含的原子数为NA |
| B、在常温常压下,22g二氧化碳中含有的原子数为1.5 NA |
| C、在标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
| D、在非标准状况下,22.4LO2含有的分子数一定不是NA |
下列说法不正确的是( )
| A、6.02×1023就是阿伏加德罗常数 |
| B、0.012 kg 12C含有的碳原子数就是阿伏加德罗常数的值 |
| C、含有阿伏加德罗常数个粒子的物质的量是1 mol |
| D、1 mol NH3所含原子数约是2.408×1024 |