题目内容
CO2 与NaOH溶液发生反应时,反应产物与反应物的量有关,当CO2 过量时,生成NaHCO3;当NaOH过量时,生成Na2CO3.
(1)请写出上述两个反应的离子方程式;
(2)现有某浓度的NaOH溶液500mL来吸收1120mL(标况)的CO2 ,完全反应后溶液中溶质的质量为4.64g,求该NaOH溶液的物质的量浓度.
(1)请写出上述两个反应的离子方程式;
(2)现有某浓度的NaOH溶液500mL来吸收1120mL(标况)的CO2 ,完全反应后溶液中溶质的质量为4.64g,求该NaOH溶液的物质的量浓度.
考点:化学方程式的有关计算
专题:
分析:(1)少量CO2 和NaOH溶液反应生成Na2CO3,过量CO2 和NaOH溶液反应生成NaHCO3,据此书写规则书写离子方程式;
(2)n(CO2)=
=0.05mol,如果二氧化碳完全转化为Na2CO3,根据碳原子守恒知,n(Na2CO3)=n(CO2)=0.05mol,m(Na2CO3)=0.05mol×106g/mol=5.0g,如果二氧化碳完全转化为NaHCO3,根据碳原子守恒知,n(NaHCO3)=n(CO2)=0.05mol,m(NaHCO3)=0.05mol×84g/mol=4.3g,实际上溶质的质量介于二者之间,所以溶质为Na2CO3、NaHCO3的混合物,根据C原子守恒、质量进行计算,再根据Na原子守恒计算氢氧化钠的浓度.
(2)n(CO2)=
| 1.12L |
| 22.4L/mol |
解答:
解:(1)少量CO2 和NaOH溶液反应生成Na2CO3,离子方程式为CO2+2OH-=CO32-+H2O,过量CO2 和NaOH溶液反应生成NaHCO3,离子方程式为CO2+OH-=HCO3-,答:离子方程式分别为+2OH-=CO32-+H2O;CO2+OH-=HCO3-;
(2)n(CO2)=
=0.05mol,如果二氧化碳完全转化为Na2CO3,根据碳原子守恒知,n(Na2CO3)=n(CO2)=0.05mol,m(Na2CO3)=0.05mol×106g/mol=5.0g,如果二氧化碳完全转化为NaHCO3,根据碳原子守恒知,n(NaHCO3)=n(CO2)=0.05mol,m(NaHCO3)=0.05mol×84g/mol=4.3g,实际上溶质的质量介于二者之间,所以溶质为Na2CO3、NaHCO3的混合物,
设Na2CO3、NaHCO3的物质的量分别为xmol、ymol,
根据C原子守恒、质量列方程组为
解得
,
根据Na原子守恒得n(NaOH)=2n(Na2CO3)+n(NaHCO3)=0.02mol×2+0.03mol=0.07mol,
则c(NaOH)=
=0.14mol/L,
答:NaOH的物质的量浓度为0.14mol/L.
(2)n(CO2)=
| 1.12L |
| 22.4L/mol |
设Na2CO3、NaHCO3的物质的量分别为xmol、ymol,
根据C原子守恒、质量列方程组为
|
解得
|
根据Na原子守恒得n(NaOH)=2n(Na2CO3)+n(NaHCO3)=0.02mol×2+0.03mol=0.07mol,
则c(NaOH)=
| 0.07mol |
| 0.5L |
答:NaOH的物质的量浓度为0.14mol/L.
点评:本题考查根据方程式的计算,侧重考查分析问题、计算能力,(2)题正确判断溶液中溶质成分是解本题关键,利用原子守恒分析解答,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知标准状况下:①6.72L CH4②3.01×1023HCl ③23.1g CCl4④2.3g Na,下列对四种物质的关系由小到大表示正确的是( )
| A、体积 ④<①<②<③ |
| B、密度 ①<④<③<② |
| C、原子数 ④<③<②<① |
| D、质量 ④<①<③<② |
在相同物质的量的下列分子中,电子总数最少的是( )
| A、CO |
| B、O2 |
| C、H2S |
| D、NO |
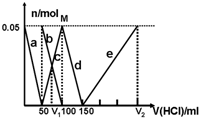 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )| A、M点时生成的CO2为0 mol |
| B、V1:V2=1:4 |
| C、原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| D、a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |
下列过程属于物理变化的是( )
| A、活性炭使红墨水褪色 |
| B、SO2使品红溶液褪色 |
| C、漂白粉使某些染料褪色 |
| D、氯水使有色布条褪色 |