题目内容
5.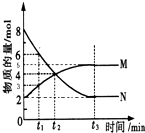 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:(1)该反应的化学方程式为2N?M.
(2)t2时刻,正逆反应速率大小关系为V正> V逆.(填“>”、“=”、“<”)
(3)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:0.25mol/(L•min).
(4)t3时刻化学反应达到平衡时反应物的转化率为75%.
(5)如果升高温度则V逆增大(填增大、减小或不变).
分析 (1)根据图可知,在t2时刻气体N的物质的量在减小为反应物,M的物质的量在增加为生成物,反应的物质的量变化之比等于化学方程式计量数之比,据此书写化学方程式;
(2)根据图可知,在t2时刻气体N的物质的量在减小,M的物质的量在增加,所以反应在向正反应方向进行,此时V正>V逆,据此答题;
(3)根据v=$\frac{△c}{△t}$计算反应速率;
(4)根据图可知,从反应开始N的物质的量在减小,所以N为反应物,根据转化率=$\frac{消耗量}{起始量}$×100%计算;
(5)升高温度反应速率增大,据此答题.
解答 解:(1)根据图可知,在t2时刻气体N的物质的量在减小为反应物,M的物质的量在增加为生成物,反应的物质的量变化之比等于化学方程式计量数之比,n(N):n(M)=(8-2):(5-2)=2:1,则反应的化学方程式为:2N?M,故答案为:2N?M;
(2)根据图可知,在t2时刻气体N的物质的量在减小,M的物质的量在增加,所以反应在向正反应方向进行,此时V正>V逆,故答案为:>;
(3)根据v=$\frac{△c}{△t}$计算得M的平均化学反应速率为$\frac{\frac{4mol-2mol}{4L}}{2min}$=0.25mol/(L•min),故答案为:0.25mol/(L•min);
(4)根据图可知,从反应开始N的物质的量在减小为反应物,M的物质的量在增加为生成物,根据转化率=$\frac{消耗量}{起始量}$×100%计算得N的转化率为$\frac{8mol-2mol}{8mol}$11111111×100%=75%,故答案为:75%;
(5)升高温度可逆反应中的正逆反应速率都增大,故答案为:增大.
点评 本题主要考查了化学反应速率的计算、转化率的计算、影响化学反应速率的因素等知识点,难度不大,解题时注意基础知识的灵活运用.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.35kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.57kJ•mol-1
与这些碳完全燃烧相比,损失的热量为( )
| A. | 1569.84kJ | B. | 78.584kJ | C. | 6548.6kJ | D. | 4978.88kJ |
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 用C表示的反应速率是0.2 mol/(L•s) | |
| C. | 2 min末的反应速率,用B表示是0.3 mol/(L•min) | |
| D. | 2 min内,用B和C表示的反应速率之比为2:3 |
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 该烃苯环上的一氯取代物最多有4种 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 分子中至少有16个碳原子处于同一平面上 | |
| D. | 该烃属于苯的同系物 |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取 0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是溶液蓝色褪去,且半分钟内不变色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
③该试样中CuCl2•2H2O的质量分数为95%.
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.