题目内容
16.200gC不完全燃烧所得产物中,CO所占体积为$\frac{1}{3}$,CO2为$\frac{2}{3}$,且:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.35kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.57kJ•mol-1
与这些碳完全燃烧相比,损失的热量为( )
| A. | 1569.84kJ | B. | 78.584kJ | C. | 6548.6kJ | D. | 4978.88kJ |
分析 碳不完全燃烧损失的热量为生成的一氧化碳燃烧放出的热量.根据碳原子守恒计算出一氧化碳的物质的量,再根据一氧化碳燃烧的热化学方程式计算.
解答 解:100g碳的物质的量为:$\frac{200g}{12g/mol}$=$\frac{50}{3}$mol,
所以CO的物质的量为:$\frac{50}{3}$mol×$\frac{1}{3}$=$\frac{50}{9}$mol,
由于CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.57kJ/mol,所以$\frac{50}{9}$molCO燃烧放出的热量为282.57kJ/mol×$\frac{50}{9}$mol=1569.84kJ,
即100g碳不完全燃烧生成$\frac{50}{9}$molCO损失的热量为1569.84kJkJ,
故选A.
点评 本题考查反应热的计算,难度中等,关键在于清楚碳不完全燃烧损失的热量为生成的一氧化碳燃烧放出的热量,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
20.下列叙述正确的是( )
| A. | 升高温度活化能降低 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 |
1.把生锈的铁钉放入足量的盐酸中,可能发生的反应是( )
| A. | 只发生复分解反应 | B. | 只发生置换反应 | ||
| C. | 发生置换反应和化合反应 | D. | 发生复分解反应和置换反应 |
4. 2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
 2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )| A. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(l)△H=-50kJ•mol-1 | |
| B. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-50kJ•mol-1 | |
| C. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(l)△H=-2000kJ•mol-1 | |
| D. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-2000kJ•mol-1 |
1.下列各组物质中,既不是同系物,又不是同分异构体的是( )
| A. | 苯甲酸和  | B. | 乙酸和2-甲基丙酸 | ||
| C. | 硝基乙烷和氨基乙酸 | D. |  和 和  |
8.下列说法正确的是( )
| A. | 干燥的氯气有漂白性,还能用作杀菌消毒剂 | |
| B. | 含金属元素的离子不一定都是阳离子 | |
| C. | 工业上可通过电解饱和食盐水制得金属钠 | |
| D. | 氢氧化铝具有两性,既可溶于盐酸也可溶于氨水 |
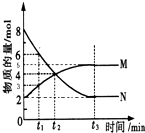 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示: