题目内容
14.为了检验装置Ⅴ中有无氯气产生及证明纯净干燥氯气有无漂白性,可用图为实验所提供的仪器和药品.
回答下列问题:
(1)各仪器装置连接的顺序为(填接口字母)J接D、C接E、F接A、B接G.
(2)装置Ⅰ中的现象是溶液变为蓝色.其中发生反应的离子方程式为Cl2+2I-=I2+2Cl-;
(3)装置Ⅳ中发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O
装置Ⅱ中分别加入的试剂为饱和食盐水和浓硫酸.(按气体通入的先后顺序填)
(4)装置Ⅴ中发生反应的化学方程式为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
若实验室用装置Ⅴ为气体发生装置,还能用来制HCl气体,实验室制备该气体的化学方程式为NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑.
分析 (1)根据实验目的先制取干燥的氯气,然后检验干燥氯气的漂白性;再利用卤素单质之间的氧化性关系设计实验检验卤素氧化性的强弱;
(2)根据氯气氧化性强于碘单质,淀粉遇碘变蓝判断现象;写出氯气与碘离子反应的离子方程式;
(3)装置Ⅳ中发生反应是氯气被氢氧化钠溶液吸收生成氯化钠、次氯酸钠和水,装置Ⅱ分别用于吸收氯气中的氯化氢和干燥氯气,据此选择合适的试剂;
(4)装置Ⅴ中发生反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,装置是固体和液体加热反应制备气体可以是氯气、氯化氢等气体.
解答 解:(1)证明干燥氯气无漂白性以及卤素氧化性的强弱,可先制取氯气再进行性质实验,氯气氯气使用装置Ⅵ,然后使用装置Ⅱ除去氯气中的装置氯化氢、干燥氯气,将干燥的氯气通入装置Ⅲ检验干燥氯气是否具有漂白性,再将氯气通入装置Ⅰ检验氯气的氧化性与碘单质氧化性强弱,最后使用使用装置Ⅳ吸收多余的氯气,所以各仪器装置连接的顺序为:J接 D、C 接E、F接A、B接G,
故答案为:J;D;C;E;F;A;B;G;
(2)氯气通入碘化钠溶液中,碘离子被氯气氧化成碘单质,溶液变成蓝色,反应的离子方程式为:Cl2+2I-=I2+2Cl-,
故答案为:溶液变为蓝色;Cl2+2I-=I2+2Cl-;
(3)装置Ⅳ中发生反应是氯气被氢氧化钠溶液吸收生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,仪器Ⅱ中的作用是除去氯气中的氯化氢和干燥氯气,使用饱和食盐水除去杂质氯化氢,使用浓硫酸干燥氯气,所以盛放的试剂为饱和食盐水和浓硫酸,
故答案为:饱和食盐水;浓硫酸;
(4)装置Ⅴ中发生反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,装置是固体和液体加热反应制备气体可以是氯气、氯化氢等气体,反应的化学方程式为:NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑,
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;HCl;NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑.
点评 本题考查了氯、溴、碘的性质实验和气体制备,主要考查了实验装置的选择及试剂的选择,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

 2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )| A. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(l)△H=-50kJ•mol-1 | |
| B. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-50kJ•mol-1 | |
| C. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(l)△H=-2000kJ•mol-1 | |
| D. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-2000kJ•mol-1 |
| A. | 二氧化碳与赤热的炭反应生成一氧化碳 | |
| B. | 葡萄糖在人体内氧化分解 | |
| C. | 锌粒与稀硫酸反应制取氢气 | |
| D. | 氢氧化钠与盐酸反应 |
| A. | C6H6(l)+7.5O2(g)→6CO2(g)+3H2O(l)+41.8kJ | |
| B. | C6H6(l)+7.5O2(g)→6CO2(g)+3H2O(l)+3260.4kJ | |
| C. | 2C6H6(l)+15O2(g)→12CO2(g)+6H2O(l)+41.8kJ | |
| D. | 2C6H6(l)+15O2(g)→12CO2(g)+6H2O(l)+3260.4kJ |
| A. | 0.1 mol Na2O2含有的阴、阳离子总数是0.3 NA | |
| B. | 1 mol•L-1的醋酸溶液中含醋酸分子数为NA | |
| C. | 常温常压下,2.24 L乙烯含有的碳碳双键数为0.1 NA | |
| D. | NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- |
| A. | 常温下,14g乙烯、丙烯、丁烯的混合气体,其原子数为3NA | |
| B. | 常温常压下,22.4L CO2含有CO2分子数为NA | |
| C. | 0.5mol•L-1 的CuCl2溶液中含Cl-数为 NA | |
| D. | 标准状况下,11.2L的CHCl3所含有的原子数为NA |
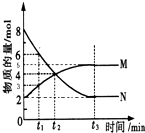 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示: