题目内容
9.在3NO2+H2O=2HNO3+NO反应中,被氧化的元素是N,被还原的元素是N;氧化剂是NO2,还原剂是NO2,氧化剂与还原剂的物质的量之比为1:2;氧化产物是HNO3,还原产物是NO;当有3molNO2参加反应时,转移电子总数为2NA,当转移4mol电子时,生成标准状况下的NO44.8升.分析 3NO2+H2O═2HNO3+NO反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,根据化合价的变化计算.
解答 解:3NO2+H2O═2HNO3+NO反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,被氧化的元素和被还原的元素都是N元素,所以NO2既是氧化剂也是还原剂,氧化剂被还原生成还原产物为NO,还原剂被氧化生成氧化产物为HNO3,氧化剂与还原剂的物质的量之比为1:2;当有3molNO2参加反应时,转移电子总数为2NA;当转移4mol电子时,生成NO为2mol,在标准状况下的体积为44.8L;
故答案为:N; N; NO2; NO2; 1:2; HNO3;NO; 2NA; 44.8.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意把握反应的特点,从元素化合价的角度认识氧化还原反应的相关概念、把握物质的性质,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列叙述正确的是( )
| A. | 升高温度活化能降低 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 |
17.下列表述正确的是( )
| A. | S2-的结构示意图: | B. | 碳原子电子式为  | ||
| C. | 氟化钠的电子式: | D. | 氨气分子的结构式: |
14.实验室进行下列实验时,一定不需要使用“沸石”的是( )
| A. | 制取蒸馏水 | B. | 分馏石油 | C. | 制取乙烯 | D. | 溴乙烷的水解 |
1.把生锈的铁钉放入足量的盐酸中,可能发生的反应是( )
| A. | 只发生复分解反应 | B. | 只发生置换反应 | ||
| C. | 发生置换反应和化合反应 | D. | 发生复分解反应和置换反应 |
4. 2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
 2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )| A. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(l)△H=-50kJ•mol-1 | |
| B. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-50kJ•mol-1 | |
| C. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(l)△H=-2000kJ•mol-1 | |
| D. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-2000kJ•mol-1 |
 A、B、C为三种烃的含氧衍生物.它们有如下的转化关系(部分产物及反应条件已略去):其中A 的分子式是C5H10O2,C可氧化为醛,则A的结构有( )
A、B、C为三种烃的含氧衍生物.它们有如下的转化关系(部分产物及反应条件已略去):其中A 的分子式是C5H10O2,C可氧化为醛,则A的结构有( )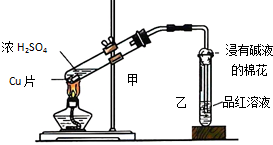 实验室常用下列装置来进行铜跟浓硫酸反应实验.请回答下列问题:
实验室常用下列装置来进行铜跟浓硫酸反应实验.请回答下列问题: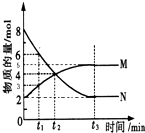 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示: