题目内容
13.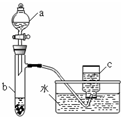 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.(1)甲组同学采用如图所示装置验证铜与硝酸的反应.已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜.
①仪器a的名称是分液漏斗.
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有酸性和强氧化性.
③待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是9.8g.
(2)乙组同学对铁与稀硝酸的反应进行探究.他们用0.1mol Fe和含有0.3mol HNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO.则
①反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+):n(Fe2+) 为1:3.
②标准状况下,计算生成NO气体的体积.(写出计算过程)
分析 (1)①根据装置图可知仪器的名称;
②反应中N元素的化合价部分未变化生成硝酸铜,部分降低生成氮的氧化物;
③铜完全反应生成硝酸铜,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据n=$\frac{m}{M}$计算铜的物质的量,根据铜原子守恒计算氢氧化铜的物质的量,再根据m=nM计算;
(2)①根据得失电子守恒和物料守恒分析解答;
②一氧化氮的物质的量为:0.3-3n(Fe3+)-2n(Fe2+)=0.3-3×0.025mol-2×0.075mol=0.075mol,所以生成NO气体的体积为:0.075mol×22.4L/mol=1.68 L.
解答 解:(1)①根据装置图可知仪器a的名称是分液漏斗,
故答案为:分液漏斗;
②反应中N元素的化合价部分未变化生成硝酸铜,硝酸表现酸,性部分降低生成氮的氧化物,硝酸表现强氧化性,
故答案为:酸性和强氧化性;
③6.4g铜的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,向b中液体里加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据铜原子守恒可知n[Cu(OH)2]=n(Cu)=0.1mol,故m[Cu(OH)2]=0.1mol×98g/mol=9.8g,
故答案为:9.8;
(2)①根据得失电子守恒和物料守恒可知:n(Fe3+)+n(Fe2+)=0.1; 3n(Fe3+)+2n(Fe2+)=3[0.3-3n(Fe3+)-2n(Fe2+)],解之得:n(Fe3+)=0.025mol;n(Fe2+)=0.075mol,所以溶液中Fe3+、Fe2+的物质的量之比n(Fe3+):n(Fe2+) 为 1:3,
故答案为:1:3;
②一氧化氮的物质的量为:0.3-3n(Fe3+)-2n(Fe2+)=0.3-3×0.025mol-2×0.075mol=0.075mol,所以生成NO气体的体积为:0.075mol×22.4L/mol=1.68 L,
答:生成NO气体的体积为1.68 L.
点评 本题考查硝酸的化学性质、化学计算等,难度中等,注意利用守恒思想与得失电子守恒的应用的进行的计算.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案| A. | S2-的结构示意图: | B. | 碳原子电子式为  | ||
| C. | 氟化钠的电子式: | D. | 氨气分子的结构式: |
 2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )
2013年12月2日嫦娥三号探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察.长征三号乙运载火箭用的燃料是液态偏二甲基肼C2H8N2,氧化剂是液态N2O4,已知1.5g偏二甲基肼完全燃烧生成液态水放出50kJ热量,则下列热化学方程式正确的是( )| A. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(l)△H=-50kJ•mol-1 | |
| B. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-50kJ•mol-1 | |
| C. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(l)△H=-2000kJ•mol-1 | |
| D. | C2H8N2(l)+2N2O4(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-2000kJ•mol-1 |
| A. | 苯甲酸和  | B. | 乙酸和2-甲基丙酸 | ||
| C. | 硝基乙烷和氨基乙酸 | D. |  和 和  |
| A. | 干燥的氯气有漂白性,还能用作杀菌消毒剂 | |
| B. | 含金属元素的离子不一定都是阳离子 | |
| C. | 工业上可通过电解饱和食盐水制得金属钠 | |
| D. | 氢氧化铝具有两性,既可溶于盐酸也可溶于氨水 |
| A. | Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| C. | FeBr2溶液中加入过量的氯水:2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| D. | 铝和烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| A. | 二氧化碳与赤热的炭反应生成一氧化碳 | |
| B. | 葡萄糖在人体内氧化分解 | |
| C. | 锌粒与稀硫酸反应制取氢气 | |
| D. | 氢氧化钠与盐酸反应 |
| A. | 0.1 mol Na2O2含有的阴、阳离子总数是0.3 NA | |
| B. | 1 mol•L-1的醋酸溶液中含醋酸分子数为NA | |
| C. | 常温常压下,2.24 L乙烯含有的碳碳双键数为0.1 NA | |
| D. | NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- |
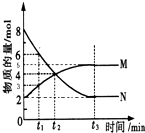 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示: