题目内容
10.某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示.
①M区发生的电极反应式为N2H4-4e-═N2↑+4H+.
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为0.5g(假设溶液电解前后体积不变).
分析 ①左端为负极,在酸性电解质中失去电子生成氮气和氢离子;②该燃料电池的能量利用率为80%,即电池转移电子的80%=电解中转移电子,结合电子转移守恒计算.
解答 解:①由氢离子的移动方向可知,M区为负极,发生的电极反应式为N2H4-4e-=N2↑+4H+,故答案为:N2H4-4e-=N2↑+4H+;
②用惰性电极,电解饱和KCl总的电极反应式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,pH值变为13时,c(OH-)=0.1mol/L,n(OH-)=0.1mol/L×0.5L=0.05mol,
N2H4~4e-~4OH-
32g 4mol
x×80% 0.05mol,
解得x=0.5g,
故答案为:0.5.
点评 本题考查电化学原理及计算等,综合性较强,侧重化学反应原理中高频考点的考查,题目难度中等.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
20.一定条件下能与CH4发生取代反应的是( )
| A. | Cl2 | B. | O2 | C. | 溴水 | D. | KMnO4酸性溶液 |
1.下列无色溶液中,能大量共存的一组是( )
| A. | Na+ Cu2+ Cl- SO42- | B. | Na+ Ca2+ CO32- NO3- | ||
| C. | Na+ H+ Cl- NO3- | D. | K+ H+ SO42- OH- |
18.下列物质敞口放置或暴露于空气中,质量增加的是( )
| A. | 浓盐酸 | B. | 浓硫酸 | C. | 浓硝酸 | D. | 稀硫酸 |
5.下列反应的离子方程式书写正确的是( )
| A. | Fe(NO3)3溶液中加入足量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 用H2O2和H2SO4的混合溶液蚀刻铜:Cu+H2O2+2H+═Cu2++2H2O | |
| C. | NH4HCO3溶液中加入足量澄清石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | C12通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O |
15.有三种短周期主族元素aX、bY、cZ.已知a+c=2b,若Z的最高价氧化物对应的水化物是中学常见的强酸,则下列有关说法中正确的是( )
| A. | 若X为O,则Y、X形成的常见化合物一定是离子化合物 | |
| B. | 若X是Na,则Z的最高正价一定是偶数 | |
| C. | 若Y为O,则非金属性:X<Y<Z | |
| D. | 若Y为Na,则X、Z不可能是同一主族元素 |
2.如图为实验室中的蒸馏装置,下列有关说法正确的是( )
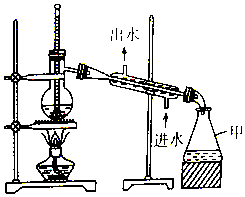

| A. | 仪器甲是锥形瓶,可直接用酒精灯加热 | |
| B. | 温度计水银球应该置于蒸馏烧瓶支管口处 | |
| C. | 直形冷凝管可用球形冷凝管代替 | |
| D. | 石油蒸馏时加沸石,制蒸馏水时不用加沸石 |
19.设NA表示阿伏加德罗常数的值.下列叙述错误的是( )
| A. | 标准状况下,33.6L氯气与足量水反应,转移电子数目为1.5NA | |
| B. | 20gH218O中含有的质子数为10NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目大于1.5NA |
11.甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-58kJ•mol-1
③CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ•mol-1
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
则x=413.
(2)若T℃时将6molCO2和 8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间的变化如图1中状态Ⅰ(图中实线)所示.图中数据A(1,6)代表在1min时H2的物质的量是6mol.
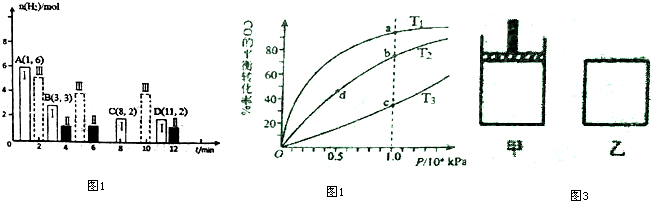
①T℃时状态I条件下,0--3min内CH3OH的平均反应速率v=0.28mol/(L•min)(保留两位有效数字),
平衡常数K=0.5;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是增大压强.
③一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是abc
a.容器中压强不变
b.CO2和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH )
d.气体的密度不再随时间的改变而变化
④CO与H2在密闭容器中发生反应①,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是A
A.温度:T1<T2<T3
B.正反应速率:v(a)>v(c);v(b)>v(d)
C.平衡常数:K(a)>K(c);K(b)>K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
⑤800K向下列起始体积相同的密闭容器中充入1molCO、2molH2发生反应①,如图3所示甲容器在反应过程中保持压强不变,乙容器保持体积不变达到平衡时H2的浓度c (H2)甲>c(H2)乙.
①CO(g)+2H2(g)═CH3OH(g)△H
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-58kJ•mol-1
③CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ•mol-1
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
(2)若T℃时将6molCO2和 8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间的变化如图1中状态Ⅰ(图中实线)所示.图中数据A(1,6)代表在1min时H2的物质的量是6mol.

①T℃时状态I条件下,0--3min内CH3OH的平均反应速率v=0.28mol/(L•min)(保留两位有效数字),
平衡常数K=0.5;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是增大压强.
③一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是abc
a.容器中压强不变
b.CO2和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH )
d.气体的密度不再随时间的改变而变化
④CO与H2在密闭容器中发生反应①,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是A
A.温度:T1<T2<T3
B.正反应速率:v(a)>v(c);v(b)>v(d)
C.平衡常数:K(a)>K(c);K(b)>K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
⑤800K向下列起始体积相同的密闭容器中充入1molCO、2molH2发生反应①,如图3所示甲容器在反应过程中保持压强不变,乙容器保持体积不变达到平衡时H2的浓度c (H2)甲>c(H2)乙.