题目内容
6.氨可用于制取氨水、液氮、氮肥(尿素、碳铵等)、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业中,最重要的化工产品之一.(1)以甲烷为原料可制得合成氨气用的氢气.图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和2mol H2(g)的能量变化示意图,写出该反应的热化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1)(△H用E1、E2、E3表示).
(2)CO可使合成氨的催化剂中毒而失去活性,因此工业上常用乙酸二氨合铜(I)溶液来吸收原料气体中的CO,反应原理:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0,
吸收后的乙酸铜氨溶液经过适当处理后可再生而恢复其吸收CO的能力,则再生的适宜条件是B(填字母序号).
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压

(3)已知N2(g)+3H2?2NH3(g)△H=-94.4kJ•mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示,各时间段最终均达平衡状态.
①在2L容器中发生反应,时段Ⅰ放出的热量为94.4kJ.
②25min时采取的某种措施是将NH3从反应体系中分离出去.
③时段Ⅲ条件下反应的平衡常数为2.37.(保留3位有数字)
(4)电化学降解N的原理如图3所示.电源正极为A(填“A”或“B”),阴极反应式为2NO3-+10e-+12H+=N2+6H2O.
分析 (1)根据图示信息,反应物的能量低于产物的能量,所以反应是吸热反应,反应热等于产物的能量和反应物的能量之差;
(2)依据平衡移动方向分析判断需要的条件,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理,再生的适宜条件是高温低压;
(3)①根据达到平衡时生成氨气的物质的量及热化学方程式N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1计算出放出的热量;
②25min时氨气的物质的量变为0,而氮气和氢气的物质的量不变;
③计算时段Ⅲ条件下达到平衡时各组分的浓度,可计算平衡常数;
(4)根据图知,Ag-Pt电极上硝酸根离子得电子发生还原反应,则Pt电极上失电子发生氧化反应,Pt电极为阳极、Ag-Pt电极为阴极;酸性条件下,阴极上硝酸根离子得电子和氢离子反应生成氮气和水.
解答 解:(1)根据图示信息,反应物的能量低于产物的能量,所以反应是吸热反应,反应热等于产物的能量和反应物的能量之差,即CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1),
故答案为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=3(E2-E1);
(2)吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理,再生的适宜条件是高温低压,
故答案为:B;
(3)①根据图象可知,达到平衡时生成的氨气的物质的量为:1.00 mol/L×2L=2.00mol,根据N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1可知生成2.00mol氨气放出的热量为94.4kJ,
故答案为:94.4kJ;
②25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时将NH3从反应体系中分离出去,
故答案为:将NH3从反应体系中分离出去;
③时段Ⅲ条件下,该反应的化学平衡常数为:K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2})c({N}_{2})}$=$\frac{0.5{0}^{2}}{0.7{5}^{3}×0.25}$≈2.37,
故答案为:2.37;
(4)根据图知,Ag-Pt电极上硝酸根离子得电子发生还原反应,则Pt电极上失电子发生氧化反应,Pt电极为阳极、Ag-Pt电极为阴极;酸性条件下,阴极上硝酸根离子得电子和氢离子反应生成氮气和水,所以A为电源正极,阴极反应式为2NO3-+10e-+12H+=N2+6H2O,
故答案为:A;2NO3-+10e-+12H+=N2+6H2O.
点评 本题考查化学平衡计算、电解原理、影响化学平衡的因素等知识点,侧重考查学生分析、计算能力,正确分析图象及灵活运用化学反应原理是解本题关键,难点是电解池中电极反应式的书写.

| A. | Fe(NO3)3溶液中加入足量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 用H2O2和H2SO4的混合溶液蚀刻铜:Cu+H2O2+2H+═Cu2++2H2O | |
| C. | NH4HCO3溶液中加入足量澄清石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | C12通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O |
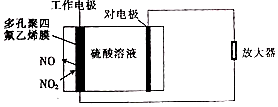 环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )
环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )| A. | “对电极”是负极 | |
| B. | “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O | |
| C. | 传感器工作时H+由工作电极移向对电极 | |
| D. | 对电极的材料可能为活泼金属锌 |
| 实验 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |||
| n(X) | n(Y) | n(M) | n(N) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0 | 0 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0 | 0 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | 0.25 | 0.25 | a |
(2)实验②中,该反应的平衡常数K=1;
(3)实验③中,此时化学反应速率是v(正)<v(逆)(填“=”、“>”或“<”);
(4)反应热△H<0(填“>”或“<”);
(5)应用化学反应速率与化学平衡原理解决化工生产实际问题,你认为下列说法不正确的是c(填字母序号).
a.化学反应速率理论可以指导怎样在一定时间内快出产品
b.勒夏特列原理可以指导怎样使有限原料多出产品
c.催化剂的使用是提高产品产率的有效办法
d.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
①CO(g)+2H2(g)═CH3OH(g)△H
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-58kJ•mol-1
③CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ•mol-1
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
(2)若T℃时将6molCO2和 8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间的变化如图1中状态Ⅰ(图中实线)所示.图中数据A(1,6)代表在1min时H2的物质的量是6mol.
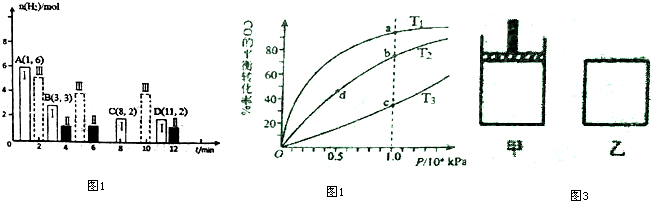
①T℃时状态I条件下,0--3min内CH3OH的平均反应速率v=0.28mol/(L•min)(保留两位有效数字),
平衡常数K=0.5;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是增大压强.
③一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是abc
a.容器中压强不变
b.CO2和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH )
d.气体的密度不再随时间的改变而变化
④CO与H2在密闭容器中发生反应①,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是A
A.温度:T1<T2<T3
B.正反应速率:v(a)>v(c);v(b)>v(d)
C.平衡常数:K(a)>K(c);K(b)>K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
⑤800K向下列起始体积相同的密闭容器中充入1molCO、2molH2发生反应①,如图3所示甲容器在反应过程中保持压强不变,乙容器保持体积不变达到平衡时H2的浓度c (H2)甲>c(H2)乙.
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:Li>Na>K>Rb>Cs | ||
| C. | 酸性:HClO4>H2SO4>H2SeO4 | D. | 碱性:KOH>Mg(OH)2>Al(OH)3 |
| A. | -1 135.7 kJ•mol-1 | B. | 601.7 kJ•mol-1 | ||
| C. | -466.3 kJ•mol-1 | D. | 1 000.3 kJ•mol-1 |