题目内容
19.下列反应的离子方程式正确的是( )| A. | 硫酸铝溶液和过量的NaOH溶液反应:Al3++4OH-=AlO2-+2H2O | |
| B. | Mg(OH)2与盐酸的反应:H++OH-═H2O | |
| C. | 硫化亚铁(FeS)与盐酸反应:S2-+2H+═H2S↑ | |
| D. | 钠和冷水反应:Na+2H2O═Na++H2↑+2OH- |
分析 A.反应生成偏铝酸钠和水;
B.氢氧化镁在离子反应中保留化学式;
C.FeS在离子反应中保留化学式;
D.电子、电荷不守恒.
解答 解:A.硫酸铝溶液和过量的NaOH溶液反应的离子反应为Al3++4OH-=AlO2-+2H2O,故A正确;
B.Mg(OH)2与盐酸的反应的离子反应为2H++Mg(OH)2═2H2O+Mg2+,故B错误;
C.硫化亚铁(FeS)与盐酸反应的离子反应为FeS+2H+═H2S↑+Fe2+,故C错误;
D.钠和冷水反应的离子反应为2Na+2H2O═2Na++H2↑+2OH-,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
9.苹果酸的结构简式为 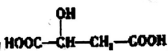 ,下列说法错误的是( )
,下列说法错误的是( )
 ,下列说法错误的是( )
,下列说法错误的是( )| A. | lmol苹果酸可与2 molNaOH发生中和反应 | |
| B. | 一定条件下,苹果酸与乙酸或乙醇均能发生酯化反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | lmol苹果酸与足量金属Na反应生成1.5molH2 |
10.下列所得溶液的物质的量浓度为0.1mol/L的是( )
| A. | 将0.1 mol 氨气充分溶解在1L水中 | |
| B. | 将10克质量分数98%的硫酸与990克水混合 | |
| C. | 将25克胆矾溶于水配成1L 溶液 | |
| D. | 将10 mL1mol/L的盐酸与90 mL水充分混合 |
7.从中草药茵陈蒿中可提取出一种利胆有效成分--对羟基苯乙酮,结构简式为: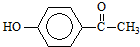 .这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )
.这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )
 .这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )
.这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )| A. | 能跟氢氧化钠反应 | |
| B. | 能跟浓溴水反应 | |
| C. | 能跟碳酸氢钠反应 | |
| D. | 在催化剂存在时能被还原成含醇羟基的物质 |
14.下列说法正确的是( )
①有化学键破坏的变化一定属于化学变化
②发生了颜色变化的一定是化学变化
③电解质溶液导电一定发生化学变化
④用糯米、酒曲和水制成甜酒酿,一定是化学变化
⑤用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化.
①有化学键破坏的变化一定属于化学变化
②发生了颜色变化的一定是化学变化
③电解质溶液导电一定发生化学变化
④用糯米、酒曲和水制成甜酒酿,一定是化学变化
⑤用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化.
| A. | ①③⑤ | B. | ②③④ | C. | ③④⑤ | D. | 全部 |
4.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 7.8gNa2O2中含有的阴离子数等于0.1NA | |
| D. | 标况下,2.24LH2O所含分子数为0.1NA |
8.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如表所示.据此,将甲和乙分离的最佳方法是( )
| 物质 | 熔点(℃) | 沸点(℃) | 密度 (g•cm-3) | 二者溶解性关系 |
| 甲 | -98 | 57.5 | 1.93 | 互不相溶 |
| 乙 | -84 | 77 | 0.90 |
| A. | 蒸馏 | B. | 蒸发 | C. | 过滤 | D. | 分液 |
9. 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点Al(OH)3开始溶解 | |
| B. | c点溶液呈中性 | |
| C. | b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ | |
| D. | ab段与bc段消耗的Ba(OH)2溶液的体积相等 |