题目内容
18.原子序数依次增大的A、B、C、D、E五种短周期元素.A、B可形成密度为0.76g/L(标准状况下) 的气体,C的最外层电子数为其内层电子数的3倍,A与D、C与E同主族.下列说法正确的是( )| A. | D2E2和A2C2两种化合物对应晶体中的化学键类型相同 | |
| B. | 只含A、B、C三种元素的某化合物水溶液,可能呈碱性或酸性 | |
| C. | 原子半径大小:D>B>C;简单离子半径大小:D+>E2->C2- | |
| D. | A2C的稳定性强于A2E、沸点高于A2E,均因为A-C键键能大于A-E键键能 |
分析 原子序数依次增大的A、B、C、D、E五种短周期元素.A、B可形成密度为0.76g/L(标准状况下) 的气体,M=0.76g/L×22.4L/mol=17g/mol,可知A为H,B为N元素;C的最外层电子数为其内层电子数的3倍,则C为O元素;A与D、C与E同主族,可知D为Na,E为S,以此来解答.
解答 解:由上述分析可知,A为H,B为N,C为O,D为Na,E为S,
A.Na2S2含离子键、共价键,H2O2只含共价键,故A错误;
B.只含A、B、C三种元素的某化合物为硝酸或硝酸铵、一水合氨,可能呈碱性或酸性,故B正确;
C.电子层越多,半径越大,同周期从左向右原子半径减小,具有相同电子排布的离子中原子序数大的离子半径小,则原子半径大小:D>B>C,而简单离子半径大小:E2->C2->D+,故C错误;
D.非金属性越强,对应氢化物越稳定,且水中含氢键,则A2C的稳定性强于A2E,因为A-C键键能大于A-E键键能,而沸点高于A2E,与氢键有关,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、元素的位置、原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列做法不利于食品安全的是( )
| A. | 在食盐中添加适量的碘酸钾 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| C. | 一些工业用燃料,如苏丹红等,对人体无毒害作用,也可用作食用色素 | |
| D. | 研究高效低毒的农药,降低蔬菜的农药残留量 |
6.在一定条件下,常温常压下的水可瞬间结成冰,俗称“热冰”,下列说法正确的是( )
| A. | “热冰”与水的化学性质相同 | B. | “热冰”在任何条件下都不会融化 | ||
| C. | 水结成“热冰”分子间的间隔变大 | D. | 结成“热冰”后,分子停止运动 |
13.相等物质的量的CO和CO2,下列比较中正确的是( )
①所含的分子数目之比为1:1 ②所含的氧原子数目之比为1:2
③所含的碳原子数目之比为1:1 ④所含的原子总数目之比为2:3.
①所含的分子数目之比为1:1 ②所含的氧原子数目之比为1:2
③所含的碳原子数目之比为1:1 ④所含的原子总数目之比为2:3.
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
3.如图为农夫山泉矿泉水瓶上的部分说明文字,列出了饮用天然水理化指标,这里的钙、钾、钠是指( )


| A. | 原子 | B. | 分子 | C. | 单质 | D. | 元素 |
10.实验室保存下列物质的方法中,正不确的是( )
| A. | 少量金属钠保存在水里 | |
| B. | 澄清石灰水需盛放在用橡皮塞塞紧的试剂瓶中 | |
| C. | 为了防止Fe2+被氧化,可在盛FeSO4溶液的试剂瓶中加少量铁粉 | |
| D. | 新制氯水通常保存在棕色试剂瓶中 |
7.下列说法正确的是( )
| A. | 水库中的钢闸门通常连接锌块,是采用了牺牲阳极的阴极保护法 | |
| B. | 化学电源都是一次能源 | |
| C. | 铁的表面镀铜的过程中,铜极连接电源负极 | |
| D. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其组成成分金属强 |
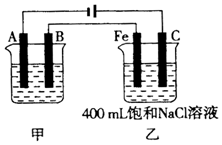 如图为相互串联的甲、乙两电解池.
如图为相互串联的甲、乙两电解池.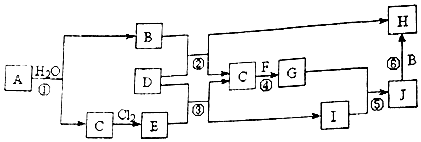
 .
.