题目内容
1.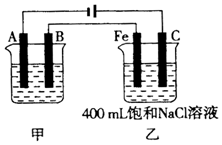 如图为相互串联的甲、乙两电解池.
如图为相互串联的甲、乙两电解池.试回答:
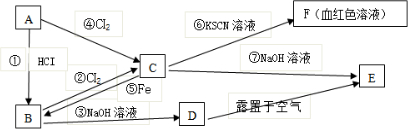
(1)若甲电解池利用电解原理在铁上镀银,则A是铁(填电极材料),B是银(填电极材料),应选用的电解质溶液是AgNO3溶液.
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈红色,其电极反应式为2Cl--2e-=Cl2↑,电解总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是448mL,若乙电解池中剩余溶液仍为400mL,则电解后所得溶液的pH等于13.
分析 根据电源的正负极可判断A、B、Fe、C分别为电解池的阴极、阳极、阴极、阳极,在阴极上发生还原反应,在阳极上发生氧化反应,乙池反应中阴极:2H2O+2e-═H2↑+20H-,阳极:2Cl--2e-═Cl2↑,若甲为用电解原理给铁片镀银的装置,阴极反应为Ag++e-=Ag,阳极反应为Ag-e-=Ag+,电解质溶液应选与镀层具有相同金属离子的可溶性盐溶液;然后根据电极反应以及两个串联电解池转移电子数目相等计算.
解答 解:(1)根据电源的正负极可判断A、B、Fe、C分别为电解池的阴极、阳极、阴极、阳极,在阴极上发生还原反应,在阳极上发生氧化反应,在铁片上镀银时,镀层金属银为电解池的阳极,阳极上的电极反应式为Ag-e-=Ag+,镀件金属铁为电解池的阴极,阴极上的电极反应式Ag++e-=Ag,电解质溶液含有镀层金属离子,应为可溶性硝酸银溶液.
故答案为:铁;银;AgNO3溶液;
(2)乙池电解NaCl溶液,阴极反应为:2H2O+2e-═H2↑+20H-,滴加酚酞溶液后,阴极溶液变红.阳极反应式为:
2Cl--2e-═Cl2↑,有黄绿色的氯气生成,氯气溶于水使溶液呈浅黄绿色,电解的总的离子方程式为:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,故答案为:红;2Cl--2e-=Cl2↑;2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)甲槽阴极反应为Ag++e-=Ag,阴极增重4.32g,应为银的质量,n=$\frac{4.32g}{108g/mol}$=0.04 mol,转移的电子为0.04mol,两个电解池串联,转移的电子数目相等,乙槽阳极反应为2Cl--2e-═Cl2↑,转移的电子为0.04mol时,在阳极上生成气体的物质的量为0.02mol,放出气体在标准状况下的体积为0.02mol×22.4L/mol=0.448L=448mL,生成0.02mol氯气时同时生成0.04mol氢氧化钠,
则氢氧化钠的物质的量浓度=$\frac{0.04mol}{0.4L}$=0.1mol/L,
则溶液中氢离子浓度=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,
所以其pH=13,故答案为:448;13.
点评 本题考查了电镀原理及氧化还原反应的有关计算,难度不大,注意串联电解池得失电子数相等的特点.

 考前必练系列答案
考前必练系列答案| A. | 从海水中可以获得NaCl,NaCl是生产纯碱的原料 | |
| B. | Si的单晶可以作为光电转换材料用于太阳能电池 | |
| C. | 水晶、玛瑙、珍珠、宝石四种饰品的化学成分基本相同 | |
| D. | BaSO4是难溶于水的强电解质,在医学上用作钡餐 |
| A. | 1 g碳燃烧生成一氧化碳时放出126.4 kJ的热量 | |
| B. | 1 mol固体碳在氧气中燃烧生成一氧化碳气体时放出126.4 kJ的热量 | |
| C. | 1 g碳燃烧生成一氧化碳时吸收126.4 kJ的热量 | |
| D. | 12 g碳和氧气反应生成一氧化碳时放出126.4 kJ的热量 |
| A. | 常温常压下,2.24LO2、O3的混合气体含有NA个分子 | |
| B. | 28 g CO和N2混合气体含有NA个分子 | |
| C. | 标准状况下,4.48 L水含有的分子数等于0.2NA | |
| D. | 标准状况下,CO2与Na2O2反应生成2.24 L O2转移的电子数为0.4NA |
| A. | 所有含碳元素的物质都是有机化合物 | |
| B. | 有机化合物是指所有含碳的化合物 | |
| C. | CO、CO2是含碳化合物,所以它们是有机化合物 | |
| D. | 有机物中一定含碳元素 |
| A. | 10mL 18mol/L 浓硫酸与足量铜加热充分反应,其中有 0.09NA 个 H2SO4 体现 了氧化性 | |
| B. | 将 5.6g 铁在 3.36LCl2 中点燃,二者一定能恰好完全反应 | |
| C. | 100mL 1mol/L 硫酸溶液中,有 0.1mol H2SO4分子 | |
| D. | 标准状况下,22.4 L CO2和 CO 混合气体中含有的碳原 子数约为 NA |
| A. | D2E2和A2C2两种化合物对应晶体中的化学键类型相同 | |
| B. | 只含A、B、C三种元素的某化合物水溶液,可能呈碱性或酸性 | |
| C. | 原子半径大小:D>B>C;简单离子半径大小:D+>E2->C2- | |
| D. | A2C的稳定性强于A2E、沸点高于A2E,均因为A-C键键能大于A-E键键能 |