题目内容
17.如表是元素周期表的一部分| 族 周期 | |||||||
| ① | |||||||
| Li | C | ④ | ⑤ | ⑥ | |||
| ⑦ | ⑧ | ⑨ | ⑩ | ||||
| K | ⑫ | ⑬ | |||||
(2)表中元素⑤和⑦、①和⑤均可以组成原子比例为1:1的物质,这两种物质内所含有的相同的化学键是非极性共价键键(填写“离子键”、“极性共价键”或“非极性共价键”),元素⑤和⑦组成原子比例为1:1的物质的电子式为
 .
.(3)表中元素⑥⑩⑬氢化物的稳定性由大到小的顺序为:HF>HCl>HBr(填写化学式,下同);
(4)表中有一种元素的单质可作为半导体材料,它在元素周期表中的位置是第三周期ⅣA族.
分析 由元素在周期表中位置,可知①为H、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为Si、⑩为Cl、⑫为Ga、⑬为Br.
(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱;上述元素单质中,常温下呈液态的为溴;
(2)表中元素⑤和⑦原子比为1:1的物质为Na2O2,①和⑤组成原子比例为1:1的物质为H2O2;
(3)非金属性越强,对应氢化物越稳定;
(4)表中可作为半导体材料的为Si.
解答 解:由元素在周期表中位置,可知①为H、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为Si、⑩为Cl、⑫为Ga、⑬为Br.
(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,上述元素中F的非金属性最强;上述元素单质中,常温下呈液态的为溴,原子序数为35,
故答案为:F;Br;35;
(2)表中元素⑤和⑦原子比为1:1的物质为Na2O2,①和⑤组成原子比例为1:1的物质为H2O2,均高于非极性共价键,Na2O2的电子式为: ,
,
故答案为:非极性共价键; ;
;
(3)非金属性F>Cl>Br,非金属性越强,对应氢化物越稳定,故氢化物稳定性:HF>HCl>HBr,
故答案为:HF>HCl>HBr;
(4)表中可作为半导体材料的为Si,处于周期表中第三周期ⅣA族,
故答案为:第三周期ⅣA族.
点评 本题考查元素周期表与元素周期律,比较基础,需要学生熟练掌握元素周期表结构,注意对基础知识的理解掌握.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
6.2.3g由CO与H2组成的混合气体与足量的O2充分燃烧后,产物气体立即通入足量的Na2O2固体中,固体的质量增加( )
| A. | 2.3g | B. | 3.2g | C. | 4.6g | D. | 不可求 |
5.关于用水制取二级能源氢气,以下研究方向不正确的是( )
| A. | 设法将太阳光聚焦,产生高温,使水分解产生氢气 | |
| B. | 寻找特殊化学物质,使水分解产生氢气,同时释放能量 | |
| C. | 寻找特殊化学物质,用于开发廉价能源以分解水制取氢气 | |
| D. | 构成水的氢气和氧气都是可燃烧的物质,因此可研究在水不分解的情况下,使氢能成为二级能源 |
12.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:
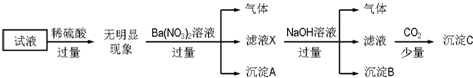
下列说法正确的是( )

下列说法正确的是( )
| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 无法确定原试液中是否含有K+ | |
| C. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| D. | 无法确定沉淀C的成分 |
2.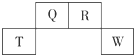 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3,下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3,下列说法正确的是( )
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3,下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3,下列说法正确的是( )| A. | Q的最高价氧化物对应水化物的酸性大于R的最高价氧化物对应水化物的酸性 | |
| B. | T的离子半径大于W的离子半径 | |
| C. | 元素T形成单质的还原性大于元素W形成单质的还原性 | |
| D. | 在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应 |
9.在石灰窑中烧制生石灰,1molCaCO3完全分解所需要的能量,可燃烧0.453mol碳来提供.设空气中O2体积分数为0.21,N2为0.79,则石灰窑产生的气体中CO2的体积分数可能是( )
| A. | 0.43 | B. | 0.47 | C. | 0.49 | D. | 0.52 |
6.如表是元素周期表的一部分,按要求完成各小题.
(1)化学性质最不活泼的元素Ar非金属性最强的元素是F金属性最强的单质Na
(2)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①③⑤三种元素的原子半径由大到小的顺序为Na>Mg>Al.
(3)①元素的某氧化物通常用作供氧剂,请写出它与⑦元素的氧化物反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ |
(2)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①③⑤三种元素的原子半径由大到小的顺序为Na>Mg>Al.
(3)①元素的某氧化物通常用作供氧剂,请写出它与⑦元素的氧化物反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
7.下列物质的熔点均按由高到低的次序排列,其原因是由于键能由大到小排列的是( )
| A. | 钠、干冰 | B. | 金刚石、晶体硅 | ||
| C. | 碘化氢、溴化氢 | D. | 二氧化硅、二氧化碳 |