题目内容
12.下列叙述正确的是( )| A. | 不同元素的原子结构的分子只含极性共价键 | |
| B. | 137Cs和133Cs是中子数不同质子数相同的同种核素 | |
| C. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| D. | 同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
分析 A.H、O形成的化合物中能存在非极性共价键;
B.同种核素必须具有相同的中子数和质子数;
C.同周期从左到右金属性减弱;
D.同周期随核电荷数的增大,原子核对核外电子的引力增大,原子半径减小.
解答 解:A.H、O形成的化合物中能存在非极性共价键,如过氧化氢中存在极性键和非极性共价键,故A错误;
B.中子数不同质子数相同的原子为两种不同的核素,同种核素必须具有相同的中子数和质子数,故B错误;
C.同周期从左到右金属性减弱,所以同周期ⅠA族元素的金属性比ⅡA族元素的金属性强,故C错误;
D.同周期随核电荷数的增大,原子核对核外电子的引力增大,原子半径减小,故同周期元素(除 0 族元素外)从左到右,原子半径逐渐减小,故D正确;
故选:D.
点评 本题考查元素的性质,为高频考点,把握元素的位置及性质变化规律为解答的关键,把握元素金属性、非金属性比较即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.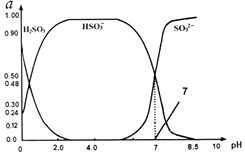 常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
 常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )| A. | 由图中数据可计算得到常温下亚硫酸溶液的Ka2 | |
| B. | 在0.1mol•L-1H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 向pH为7的溶液中滴入少量稀盐酸造成的溶液pH变化小于向pH为4.0的溶液中滴入相同量稀盐酸造成的溶液pH变化 | |
| D. | 在pH=2.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) |
20.将0.01mol的NaHCO3加入0.1mol•L-1、50mLH2SO4溶液中,充分反应后向混合液中加入1.31g的BaCl2•xH2O,Ba2+完全沉淀,则x的值不可能是( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
7.一定量的铜与一定量的浓硝酸恰好完全反应生成NO与NO2,反应中被还原的HNO3占HNO3总量的$\frac{1}{3}$,还原产物中NO、NO2的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
17.原子序数依次增大的4种元素a、b、c、d,它们的原子L层电子数分别为5、6、8、8.C+的电子层结构与Ne的电子层结构相同,d-与c+多1个电子层.下列叙述正确的是( )
| A. | 元素的非金属性a>b | |
| B. | a与b只能形成两种化合物:ab和ab2 | |
| C. | c和其他3种元素均能形成离子化合物 | |
| D. | d与a元素能形成离子化合物 |
4.如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子是Ar
(2)地壳中含量最多的金属元素是Al;非金属性最强的元素F
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.①的最高价氧化物对应的水化物的化学式为HNO3,其稀溶液与铜反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.当有0.4mol该物质被还原,则转移的电子为0.3mol.
(5)①、②、③所形成的气体氢化物的稳定性由强到弱的顺序HF>H2O>NH3
(6)完成下列反应的化学方程式:⑦的氧化物与氢氧化钠溶液反应SiO2+2NaOH=Na2SiO3+H2O,④、⑥的最高价氧化物对应的水化物两两反应:Al(OH)3+NaOH=NaAlO2+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 四 | ⑩ |
(2)地壳中含量最多的金属元素是Al;非金属性最强的元素F
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.①的最高价氧化物对应的水化物的化学式为HNO3,其稀溶液与铜反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.当有0.4mol该物质被还原,则转移的电子为0.3mol.
(5)①、②、③所形成的气体氢化物的稳定性由强到弱的顺序HF>H2O>NH3
(6)完成下列反应的化学方程式:⑦的氧化物与氢氧化钠溶液反应SiO2+2NaOH=Na2SiO3+H2O,④、⑥的最高价氧化物对应的水化物两两反应:Al(OH)3+NaOH=NaAlO2+2H2O.
下列实验操作及现象与实验结论一致的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中不一定含有SO42- |
B | 光洁的铁钉放在冷的浓硫酸中,无明显现象 | 铁钉与冷的浓硫酸不反应 |
C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
D | 向浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1的AgNO3溶液,产生的沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
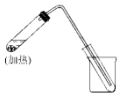 如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题: