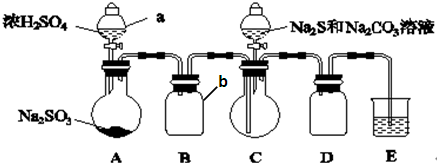
题目内容
4.下列反应中,相关坐标图错误的是( )| A. | 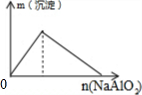 向盐酸中滴入NaAlO2溶液 | B. | 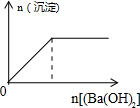 NaHSO4溶液中逐滴加入Ba(OH)2溶液 | ||
| C. | 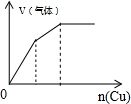 将铜粉加入到一定浓硝酸中 | D. | 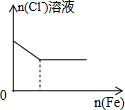 将铁粉加入到一定量氯化铁溶液中 |
分析 A.向偏铝酸钠溶液中逐滴加入稀盐酸依次发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O;
B.NaHSO4溶液中逐滴加入Ba(OH)2溶液,开始钡离子与硫酸根离子反应生成沉淀,氢离子与氢氧根离子反应生成水,当硫酸根离子沉淀完全,再加氢氧化钡时,只发生氢离子与氢氧根离子的反应;
C.铜与一定量的浓硝酸反应开始生成二氧化氮,随着反应进行,硝酸浓度降低,与铜反应生成一氧化氮;
D.铁和氯化铁反应生成氯化亚铁.
解答 解:A.向偏铝酸钠溶液中逐滴加入稀盐酸依次发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,先产生沉淀,后沉淀溶解,所用稀盐酸溶液体积为1:3,图象A符合,故A正确;
B.NaHSO4溶液中逐滴加入Ba(OH)2溶液,开始钡离子与硫酸根离子反应生成沉淀,氢离子与氢氧根离子反应生成水,当硫酸根离子沉淀完全,再加氢氧化钡时,只发生氢离子与氢氧根离子的反应,所以开始产生沉淀,一段时间后,沉淀的量保持不变,图象B符合,故B正确;
C.发生的反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据方程式知,Cu和二氧化氮的曲线斜率大、和NO的曲线斜率小,图象C符合,故C正确;
D.发生的反应为 Fe+2FeCl3=3FeCl2,但氯离子个数始终不变,图象D不符合,故D错误;
故选:D.
点评 本题考查图象分析,侧重考查学生分析判断能力,明确物质的性质及物质之间的反应是解本题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.雾霾天气对环境造成了严重影响,部分城市开展PM2.5和臭氧(O3)的监测.下列有关说法正确的是( )
| A. | 臭氧的摩尔质量是48 g | |
| B. | 1mol臭氧的体积是22.4L | |
| C. | 16 g臭氧中含有6.02×1023个氧原子 | |
| D. | 已知每个氧原子内有8个质子,那么1 mol臭氧中含有3mol质子 |
12.下列关于晶体和非晶体叙述不正确的是( )
| A. | 晶体区别于非晶体的本质特征是晶体中原子呈周期性有序排列 | |
| B. | 缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为的立方体晶体体现了晶体的自范性 | |
| C. | M为第ⅡA元素,MCO3中M2+半径越大,MCO3热分解温度越低 | |
| D. | 干冰中CO2的配位数12大于冰中H2O的配位数4,是由于丙中水分子之间存在氢键 |
19.某溶液中含有0.3mol NaNO3和0.5mol H2SO4,向该溶液中加入14.4g金属Mg,充分反应后产生NO气体(假定无其他还原产物),NO在标准状况下的体积为( )
| A. | 8.96L | B. | 6.72L | C. | 5.6L | D. | 4.48L |
5.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| B | 滴加盐酸溶液 | 产生无色无味气体使澄清石灰水变浑浊 | 原溶液中有CO32- |
| C | 滴加硫酸钠和稀硝酸溶液 | 产生白色沉淀 | 原溶液中有Ba2+ |
| D | 滴加稀NaOH溶液 | 生成白色沉淀 | 原溶液中一定有Mg2+ |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 | |
| C. | 室温下,pH=3的亚硫酸溶液中的氢离子浓度与pH=11的氨水中的氢氧根离子浓度相等 | |
| D. | 室温时,将pH=5的H2SO4溶液稀释1000倍,则c(H+):c (SO42-)=2:1 |
3.如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.下列说法正确的是( )
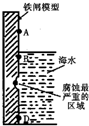

| A. | 该过程发生了析氢腐蚀 | |
| B. | 铁单质被直接氧化生成Fe3+ | |
| C. | B点附近会生成最多的铁锈 | |
| D. | 在铁闸上镶嵌一些铜片可以减缓海水对铁闸的腐蚀 |