题目内容
8.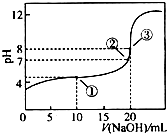 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )| A. | 该滴定过程可采用酚酞做指示剂 | |
| B. | 图中点③所示溶液中,c(CH3COO-)<c(Na+) | |
| C. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| D. | 滴定过程中的某点,会有c(Na+)=c(CH3COO-)>c(H+)=c(OH-)的关系存在 |
分析 A.在酸碱中和滴定的实验中,一般不用石蕊作指示剂,主要原因是:石蕊的“红色→紫色”、“紫色→蓝色”的颜色变化不够明显,不利于及时、准确地作出酸碱是否恰好完全中和的判断;
B.在②处溶液的pH=7,溶液显示中性,根据电荷守恒可以判断c(CH3COO-)=c(Na+);
C.①点时溶液显示酸性,氢离子抑制了水的电离,而在③点醋酸和氢氧化钠恰好反应生成醋酸钠,醋酸根离子水解促进了水的电离;
D.根据电荷守恒可知,溶液中一定不会出现c(Na+)>c(CH3COO-)>c(H+)>c(OH-).
解答 解:A.中和滴定中,由于其颜色变化明显,可以选用酚酞作指示剂,故A正确;
B.图中点③所示溶液中,溶液显示中性,则c(OH-)>c(H+),根据电荷守恒可知:c(CH3COO-)<c(Na+),故B正确;
C.图中点①所示溶液中,氢离子抑制了水的电离,导致水的电离程度减小,而在点③所示溶液中,溶质为醋酸钠,醋酸根离子水解促进了水的电离程度,所以水的电离程度:①<③,故C错误;
D.当溶液显中性时,溶液中c(H+)=c(OH-),根据电荷守恒可知c(Na+)=c(CH3COO-),故溶液中离子浓度存在c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故D正确;
故选C.
点评 本题考查酸碱混合溶液定性判断及溶液中离子浓度大小比较,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,注意电荷守恒、物料守恒、盐的水解等在比较离子浓度大小中的应用方法.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
19.下列有关各实验装置图的叙述中,正确的是( )


| A. | 装置①储存液溴 | B. | 装置②提纯含少量水的乙醇 | ||
| C. | 装置③不能用来吸收HCl气体 | D. | 装置④分离CCl4和水 |
16.NA表示阿伏伽德罗常数,下列判断正确的是( )
| A. | 常温下,1L0.1 mol/L的NH4NO3溶液中铵根离子为0.1NA | |
| B. | 室温下,16g O2与O3的混合气体中,含氧原子总数为NA | |
| C. | 1 mol Cl2参加反应转移的电子数一定为2NA | |
| D. | 含NA个Na+的NaOH溶解于1L水中,Na+的物质的量浓度为1 mol/L |
3.如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.下列说法正确的是( )
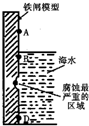

| A. | 该过程发生了析氢腐蚀 | |
| B. | 铁单质被直接氧化生成Fe3+ | |
| C. | B点附近会生成最多的铁锈 | |
| D. | 在铁闸上镶嵌一些铜片可以减缓海水对铁闸的腐蚀 |
13.下列说法正确的是( )
| A. | 标准状况下,22.4LN2和O2的混合气体中所含分子总数为6.02×1023 | |
| B. | 常温常压下,等质量的O2和O3中所含的氧原子数均为6.02×1023 | |
| C. | 2L 0.5mol/LNa2SO4溶液中所含离子总数为6.02×1023 | |
| D. | H2O2催化分解生成0.5molO2时转移电子数目为1.204×1024 |
20.已知常温下Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5×10-13,下列有关说法错误的是( )
| A. | 在饱和AgCl,AgBr的混合溶液中:$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=360 | |
| B. | 向AgCl悬浊液中滴加NaBr溶液会产生淡黄色沉淀 | |
| C. | AgCl在水中溶解度及Ksp均比在NaCl溶液中的大 | |
| D. | 欲用1L NaCl溶液将0.01 mol AgBr转化为AgCl,则c(NaCl)>3.61 mol/L |
17.化学与生产、生活密切相关.下列叙述中正确的是( )
| A. | 用浓H2SO4刻蚀工艺玻璃上的纹饰 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
18. 恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )
恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )
 恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )
恒容容器中,对于可逆反应xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量随时间的变化如图,下列说法正确的是( )| A. | x+y>z+m | |
| B. | 对反应体系加压v正>v逆 | |
| C. | 该反应正反应方向为热反应 | |
| D. | 对反应体系降低温度达平衡前v逆>v正 |