题目内容
7.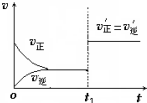 在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).
在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).a.增大N2的浓度
b.扩大容器体积
c.加入催化剂
d.升高温度
改变条件后,平衡混合物中NH3的百分含量不变(选填“增大”、“减小”、“不变”).
分析 降低温度平衡向放热的方向移动,该反应降低温度,平衡向正反应方向移动,正反应为放热反应;t1时刻,正逆反应速率同等程度的增大;催化剂对化学平衡无影响,能改变反应速率.
解答 解:降低温度平衡向放热的方向移动,在其他条件不变的情况下,降低温度平衡向正反应方向移动,所以正反应为放热反应,t1时刻,正逆反应速率同等程度的增大,则改变的条件为催化剂,催化剂对化学平衡无影响,能改变反应速率,所以C符合,因平衡未移动,则平衡混合物中NH3的百分含量不变,
故答案为:放热;c;不变.
点评 本题考查化学反应速率及化学平衡,题目难度不大,明确影响反应速率及平衡的外界因素即可解答,注意催化剂对平衡移动无影响.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
14.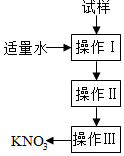 实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
 实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )| A. | 操作Ⅰ是过滤,将固体分离除去 | |
| B. | 操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠 | |
| C. | 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 | |
| D. | 操作Ⅰ~Ⅲ总共只需一次过滤操作 |
15.化学理论在元素单质及其化合物反应中应用广泛.
(1)在一定条件下,可逆反应mA?nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m大于n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H大于0(填“大于”、“小于”或“等于”).
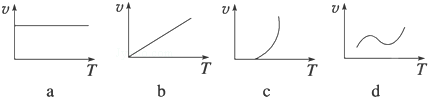
(2)某些金属氧化物(如FexOy)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是c(填序号).
(3)一定温度下,发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如表:
请回答下列问题:
①反应的△H<0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为w1,c(CO2)=0.15mol•L-1,则温度T低于(填“高于”、“低于”或“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为w2,则w1=w2(填“>”、“<”或“=”).
(1)在一定条件下,可逆反应mA?nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m大于n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H大于0(填“大于”、“小于”或“等于”).
(2)某些金属氧化物(如FexOy)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是c(填序号).

(3)一定温度下,发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如表:
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
①反应的△H<0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为w1,c(CO2)=0.15mol•L-1,则温度T低于(填“高于”、“低于”或“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为w2,则w1=w2(填“>”、“<”或“=”).
19.在一密闭容器中,反应 mA(g)?nB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数减小了 | D. | m 小于n |
16.甲、乙是两种常见短周期元素的单质,有关物质的转化关系如图所示.下列有关说法,错误的是( ) 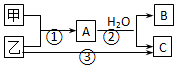

| A. | 若C为酸性气体,则B可能具有两性 | |
| B. | 若C是碱性气体,则B一定是碱 | |
| C. | 若B、C是两种酸,则B、C一定都是一元酸 | |
| D. | 以上3个转变可能都是氧化还原反应 |
17.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖.下面有关13C、15N叙述正确的是( )
| A. | 13C与15N有相同的中子数 | B. | 13C的质子数为13 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |

 如图为实验室制取乙酸乙酯的装置.
如图为实验室制取乙酸乙酯的装置. 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题: