题目内容
12. 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:(1)直接肼燃料电池原理如右图所示,则该电池中负极的电极反应式为N2H4+4OH--4e-=N2+4H2O.用此电池作电源电解含有0.10mol CuSO4和0.10mol NaCl的混合溶液100mL,假如电路中转移了0.20mol电子,且电解池的电极均为惰性电极,则阳极产生的气体在标准状况下的体积是1.68 L;
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ•mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:2N2H4(g)+N2O4(g)=3N2(g)+4H2O (g)△H=-947.6kJ•mol-1
(3)已知:2NO2(g)?N2O4(g)△H=-57.2kJ•mol-1.一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)?N2O4(g)达到平衡.写出该反应的平衡常数表达式:$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$,升高温度,该反应的平衡常数K值将减小(填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是BC(填字母序号)
A.减小NO2的浓度 B.降低温度 C.增加NO2的物质的量 D.升高温度.
分析 (1)利用N元素的化合价变化及负极发生氧化反应判断负极反应原料,然后写出负极的电极反应;根据电子守恒及溶液中放电离子先后顺序计算出阳极生成气体的物质的量及体积;
(2)①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ•mol-1,
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1,
利用盖斯定律可知,②×2-③-①得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);
(3)根据平衡常数的表达式及该反应方程式进行解答;该反应为放热反应,升高温度后平衡向着逆向移动;该反应是反应前后气体体积减小的、放热的可逆反应,要提高二氧化氮的转化率,只要改变条件使化学平衡向正反应方向移动即可.
解答 解:(1)由原电池可知,肼中N元素的化合价升高,负极发生氧化反应,则肼为负极,负极生成产物为氮气和水,则负极反应为:N2H4+4OH--4e-=N2+4H2O;
用此电池作电源电解含有0.10mol CuSO4和0.10mol NaCl的混合溶液100mL,溶液中含有氯离子0.1mol,0.1mol氯离子完全放电转移了0.1mol电子;假如电路中转移了0.20mol电子,其中有0.1mol电子用于生成0.05mol氯气;还有0.1mol电子用于生成氧气,则生成氧气的物质的量为:$\frac{0.1mol}{4}$=0.025mol,所以阳极总共生成了:0.05mol+0.025mol=0.075mol气体,标况下0.625mol气体的体积为:22.4L/mol×0.075mol=1.68L,
故答案为:N2H4+4OH--4e-=N2+4H2O;1.68;
(2)①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ•mol-1,
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1,
利用盖斯定律可知,②×2-③-①得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=△H2×2-△H1-△H3=-947.6 kJ•mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O (g)△H=-947.6 kJ•mol-1;
(3)一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)?N2O4(g)达到平衡,该反应的平衡常数表达式为:K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$;
反应2NO2(g)?N2O4(g)△H=-57.2kJ•mol-1为放热反应,升高温度,平衡向着逆向移动,二氧化氮浓度增大,四氧化二氮浓度减小,所以化学平衡常数减小;
该反应是反应前后气体体积减小的、放热的可逆反应,要使该反应向正反应方向移动,可改变反应物的浓度、体系的压强、温度等,
A、减小N02的浓度,平衡向逆反应方向移动,N02的转化率降低,故A错误;
B.降低温度,平衡向正反应方向移动,N02的转化率提高,故B正确;
C.增加N02的浓度,相当于体系压强增大,利于反应向正反应方向移动,N02的转化率提高,故C正确;
D.升高温度,平衡向逆反应方向移动,N02的转化率降低,故D错误;
故答案为:$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$; 减小;BC.
点评 本题为综合题,涉及化学反应方程式的书写、盖斯定律计算反应热及热化学方程式的书写、原电池、影响反应速率及平衡的因素、影响化学平衡的因素及化学平衡常数的含义,注意明确化学平衡常数只与温度有关,与物质的浓度无关.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案(1)酸碱中和滴定--用标准盐酸滴定未知浓度的NaOH溶液.
①下列操作造成测定结果偏高的是AC
A.盛装未知液的锥形瓶先用蒸馏水洗过,再用未知液润洗
B.滴定终点读数时,俯视滴定管刻度,其他操作正确.
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,酸式滴定管尖嘴无气泡,滴定后有气泡
②该学生的实验操作如下:
A、用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入酚酞做指示剂.
B、用待测定的溶液润洗碱式滴定管.
C、用蒸馏水洗干净滴定管.
D、取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下.
E、检查滴定管是否漏水.
F、另取锥形瓶,再重复操作一次.
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
滴定操作的正确顺序是(用序号填写)E→C→B→A→D→G→F
(2)氧化还原滴定--为了分析某残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行滴定,反应的离子方程式5Fe2++MnO${\;}_{4}^{-}$+8H+═5Fe3++Mn2++4H2O
①KMnO4标准溶液应盛装在酸式滴定管中(填“酸式”或“碱式”)
②某同学称取5.000g残留物,经预处理后在容量瓶中配制成100mL溶液,每次移取25.00mL试样溶液,用1.000×10-2 mol•L-1 KMnO4标准溶液滴定.四次实验消耗标准溶液的体积分别为19.90mL、20.00mL、20.10mL、20.60mL.计算该残留物中铁元素的质量分数是4.480%.
(3)沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是C.
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
 一定条件下,反应2NH3(g)?N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示.下列说法正确的是( )
一定条件下,反应2NH3(g)?N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示.下列说法正确的是( )| A. | 压强:p1>p2 | B. | b、c两点对应的平衡常数:Kc>Kb | ||
| C. | a点:2v(NH3)正═3v(H2)逆 | D. | a点:NH3的转化率为$\frac{1}{3}$ |
| A. | 蜡烛燃烧 | B. | 活性炭吸附冰箱中的异味 | ||
| C. | 分离液态空气制氧气 | D. | 海水晒盐 |
| A. | 氯气:K+、Na+、SiO32-、NO3- | B. | 二氧化硫:Na+、NH4+、SO32-、C1- | ||
| C. | 硫化氢:H+、K+、MnO4-、SO42- | D. | 氨气:K+、Na+、AlO2-、CO32- |
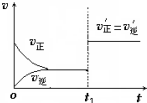 在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).
在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).