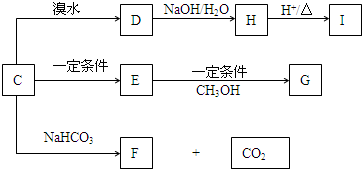
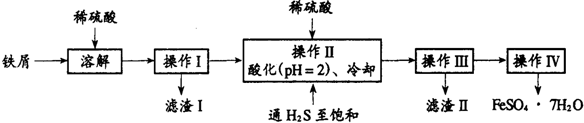
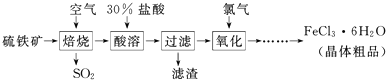
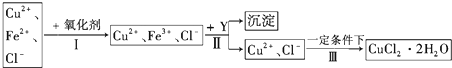
题目内容
锂原子比镁原子少1个电子层,最外层电子数也比镁原子少1,在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性.下列关于锂的判断可能正确的是( )
| A、Li能在空气中燃烧 |
| B、Li2O熔点较低 |
| C、Li2CO3能溶于水 |
| D、LiOH受热不易分解 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性,所以根据镁元素的相关性质判断锂的有关性质,
A.Li与Mg的性质相似,可以在空气中燃烧;
B.Li2O属于离子化合物,锂离子半径小于镁离子半径,其熔点比MgO高;
C.根据碳酸镁的溶解性分析Li2CO3的溶解性;
D.根据Mg(OH)2性质分析LiOH的性质.
A.Li与Mg的性质相似,可以在空气中燃烧;
B.Li2O属于离子化合物,锂离子半径小于镁离子半径,其熔点比MgO高;
C.根据碳酸镁的溶解性分析Li2CO3的溶解性;
D.根据Mg(OH)2性质分析LiOH的性质.
解答:
解:在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性,所以根据镁元素的相关性质判断锂的有关性质,
A.Li与Mg的性质相似,可以在空气中燃烧生成Li2O,故A正确;
B.MgO熔点很高,可以用作耐火材料,而MgO、Li2O都属于离子化合物,锂离子半径小于镁离子半径,其熔点比MgO高,故B错误;
C.碳酸镁微溶于水,Li2CO3与碳酸镁性质相似,不溶于水,故C错误;
D.LiOH与Mg(OH)2性质相似,Mg(OH)2受热能分解,所以LiOH受热也易分解为氧化锂与水,故D错误,
故选A.
A.Li与Mg的性质相似,可以在空气中燃烧生成Li2O,故A正确;
B.MgO熔点很高,可以用作耐火材料,而MgO、Li2O都属于离子化合物,锂离子半径小于镁离子半径,其熔点比MgO高,故B错误;
C.碳酸镁微溶于水,Li2CO3与碳酸镁性质相似,不溶于水,故C错误;
D.LiOH与Mg(OH)2性质相似,Mg(OH)2受热能分解,所以LiOH受热也易分解为氧化锂与水,故D错误,
故选A.
点评:本题考查了元素周期表知识,明确对角线规则是解本题关键,根据Mg及其化合物的性质利用知识迁移的方法分析解答,题目难度中等.

练习册系列答案
相关题目
X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A、M与X形成的化合物对应的水化物一定是强酸 |
| B、Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
| C、X、Y的简单离子半径:r(X2-)>r(Y+) |
| D、M的气态氢化物比N的气态氢化物稳定 |
下列物质属于酸性氧化物的是( )
| A、Na2O |
| B、CO |
| C、CaO |
| D、SO2 |
某主族元素R的最高正化合价与最低负化合价代数和为4,下列叙述中正确的是( )
| A、R是第ⅣA族元素 |
| B、R可形成两种氧化物RO2、RO3 |
| C、R可能处于第二周期 |
| D、R的原子序数可能为24 |