题目内容
取0.04mol KMnO4固体加热一段时间后,收集到a mol单质气体,在反应后的残留固体中加入过量的浓盐酸并加热,充分反应后又收集到b mol单质气体,假设最后锰元素全部以Mn2+存在于溶液中,则a+b的最小值为( )
| A、0.02 | B、0.04 |
| C、0.08 | D、0.1 |
考点:氧化还原反应的计算
专题:
分析:KMnO4固体,加热一段时间后,收集到气体为氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气;
根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.04×(7-2)=4a+2b,整理得a+b=0.1-a,当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,根据方程式计算氧气最大值,进而确定b(a+b)的最小值.
根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.04×(7-2)=4a+2b,整理得a+b=0.1-a,当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,根据方程式计算氧气最大值,进而确定b(a+b)的最小值.
解答:
解:KMnO4固体,加热一段时间后,收集到气体为氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到乙气体为氯气,氧气是无色无味气体,而氯气是黄绿色有刺激性气味的气体;
根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.04×(7-2)=4a+2b,整理得a+b=0.1-a,
当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4
K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.04mol×
=0.02mol,即a最大值=0.02,生成氯气最少,故a+b≥0.1-0.02=0.08,
故选C.
根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.04×(7-2)=4a+2b,整理得a+b=0.1-a,
当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4
| ||
| 1 |
| 2 |
故选C.
点评:本题考查混合物计算、氧化还原反应计算,难度中等,属于易错题目,注意充分利用整个过程中的电子转移守恒解答.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
下列图象表达正确的是( )
A、 浓硫酸的稀释 |
B、 等量的盐酸与过量的锌粉反应 |
C、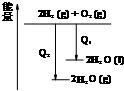 氢气与氧气反应中的能量变化 |
D、 气态氢化物沸点 |
实验室制取氧气的试管上会有MnO2,最好用下列那种试剂除去( )
| A、稀盐酸 | B、热的浓盐酸 |
| C、水 | D、NaOH溶液 |
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是( )
| A、0.3 mol NO2、0.1 mol NO |
| B、0.3 mol NO、0.1 mol NO2 |
| C、0.6 mol NO |
| D、0.3 mol NO2 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,关于该电池的说法正确的是( )
| 放电 |
| 充电 |
| A、放电时,Zn作负极,发生还原反应 |
| B、放电时,K2FeO4附近溶液pH减小 |
| C、充电时,锌极附近溶液pH减小 |
| D、充电时,阳极电极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O |