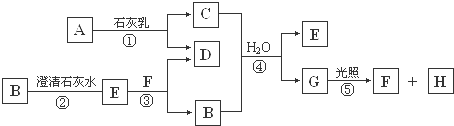
题目内容
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,关于该电池的说法正确的是( )
| 放电 |
| 充电 |
| A、放电时,Zn作负极,发生还原反应 |
| B、放电时,K2FeO4附近溶液pH减小 |
| C、充电时,锌极附近溶液pH减小 |
| D、充电时,阳极电极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据电池反应式知,放电时,锌失电子而作负极,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钾得电子而作正极,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,充电时,阳极上氢氧化铁失电子发生氧化反应,各电极反应式是放电时电极反应式的逆反应,结合电极反应式确定电解质溶液的酸碱性.
解答:
解:A.放电时,锌失电子发生氧化反应而作负极,故A错误;
B.放电时,高铁酸钾得电子而作正极,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,pH增大,故B错误;
C.充电时,锌极作阴极,电极反应式为:Zn(OH)2+2e-=Zn+2OH-,溶液pH增大,故C错误;
D.氢氧化铁失电子发生氧化反应生成高铁酸根离子,电极反应式为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O,故D正确;
故选D.
B.放电时,高铁酸钾得电子而作正极,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,pH增大,故B错误;
C.充电时,锌极作阴极,电极反应式为:Zn(OH)2+2e-=Zn+2OH-,溶液pH增大,故C错误;
D.氢氧化铁失电子发生氧化反应生成高铁酸根离子,电极反应式为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O,故D正确;
故选D.
点评:本题考查化学电源新型电池,根据元素化合价变化来确定发生的反应,再结合溶液中电解质溶液浓度变化来分析解答,会根据反应物和生成物及得失电子书写电极反应式,为学习难点.

练习册系列答案
相关题目
取0.04mol KMnO4固体加热一段时间后,收集到a mol单质气体,在反应后的残留固体中加入过量的浓盐酸并加热,充分反应后又收集到b mol单质气体,假设最后锰元素全部以Mn2+存在于溶液中,则a+b的最小值为( )
| A、0.02 | B、0.04 |
| C、0.08 | D、0.1 |
下列各组离子可能大量共存的是( )
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32 |
| D、含有大量OH-的无色溶液中:Na+、Cu2+、AlO2-、SiO32- |
中国于2011年5月1日禁止面粉添加增白剂.已知增白剂中含有CaO2,其性质与Na2O2性质相似.下列说法错误的是( )
| A、CaO2可作供氧剂、强氧化剂 |
| B、等质量的Ca与足量O2反应分别生成CaO和CaO2,转移电子数之比为1:1 |
| C、CaO2与H2O反应生成Ca(OH)2和O2 |
| D、CaO2与H2O反应的溶液中滴加酚酞,溶液只变红 |
下列关于反应过程中能量变化的说法正确的是( )
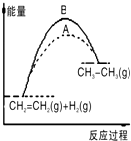

| A、在一定条件下,某可逆反应的△H=+100kJ?mol-1,则该反应正反应活化能比逆反应活化能大100kJ?mol-1 |
| B、图中A、B曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0未使用和使用催化剂时,反应过程中的能量变化 |
| C、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
| D、如图所示的能量变化判断该化学反应是放热反应 |
下列图示对应的化学实验的基本操作,其中装置合理、操作规范的是( )

| A、甲装置可用于除去碳酸钠固体中含有的少量碳酸氢钠 |
| B、乙装置可用于碳酸钙固体和氯化钠溶液的分离 |
| C、丙装置可用于分离出I2的CCl4溶液 |
| D、丁装置可用于酒精和水的分离 |
反应3A(g)+B(g)?2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
| A、v (A)=0.15 mol?L-1?s-1 |
| B、v (B)=0.3 mol?L-1?s-1 |
| C、v (C)=0.5 mol?L-1?s-1 |
| D、v(D)=0.4 mol?L-1?s-1 |
维生素C具有的性质错误的是( )
| A、难溶于水 | B、强还原性 |
| C、强氧化性 | D、加热易分解 |