题目内容
 下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO32- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4?Ba2++SO42- | 1.07×10-10 | |
| BaCO3 | BaCO3?Ba2++CO32- | 2.58×10-9 |
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为
(2)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
(3)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3?H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(4)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点.
考点:难溶电解质的溶解平衡及沉淀转化的本质,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)酸的电离平衡常数越大,该酸的酸性越强;
(2)等体积等浓度的醋酸和氨水混合,二者恰好反应生成醋酸铵,醋酸根离子和铵根离子水解程度相等,根据水解程度确定溶液的酸碱性;
(3)一水合氨的电离程度大于苯酚,则苯酚铵溶液呈碱性,根据溶液pH结合电荷守恒解答;
(4)A、加人Na2SO4后平衡逆向移动,但仍在线上移动;
B、在T1曲线上方区域(不含曲线)任意一点时,均为BaSO4过饱和溶液;
C、蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大.
(2)等体积等浓度的醋酸和氨水混合,二者恰好反应生成醋酸铵,醋酸根离子和铵根离子水解程度相等,根据水解程度确定溶液的酸碱性;
(3)一水合氨的电离程度大于苯酚,则苯酚铵溶液呈碱性,根据溶液pH结合电荷守恒解答;
(4)A、加人Na2SO4后平衡逆向移动,但仍在线上移动;
B、在T1曲线上方区域(不含曲线)任意一点时,均为BaSO4过饱和溶液;
C、蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大.
解答:
解:(1)根据表中数据知,酸的电离平衡常数大小顺序是①④③②,酸的电离平衡常数越大,其溶液酸性越强,所以这几种溶液的酸性强弱顺序是①④③②,
故答案为:①④③②;
(2)等体积等浓度的醋酸和氨水混合,二者恰好反应生成醋酸铵,醋酸根离子和铵根离子水解程度相等,所以醋酸铵溶液呈中性,根据电荷守恒得c(CH3COO-)=c(NH4+),
故答案为:=;
(3)A.苯酚的电离平衡常数小于一水合氨,所以苯酚铵溶液呈碱性,若混合液pH>7,则V≥10也可能小于10,故A错误;
B.若混合液pH<7,则苯酚过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(NH4+)<c(C6H5O-),故B错误;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,V=10时二者恰好反应生成苯酚铵,苯酚铵中水的电离被促进,苯酚中水的电离被抑制,混合液中水的电离程度大于10ml 0.01mol?L-1苯酚溶液中水的电离程度,故C错误;
D.V=5时,根据物料守恒得2c(NH3?H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH),故D正确;
故答案为:D;
(4)A.硫酸钠抑制硫酸钡电离,硫酸根离子浓度增大,导致溶液中钡离子浓度减小,所以可以使溶液由a点变为b点,故A正确;
B.在T1曲线上方区域(不含曲线)为过饱和溶液,所以有晶体析出,故B正确;
C.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变,所以蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),故C正确;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大,故D错误;
故答案为:D.
故答案为:①④③②;
(2)等体积等浓度的醋酸和氨水混合,二者恰好反应生成醋酸铵,醋酸根离子和铵根离子水解程度相等,所以醋酸铵溶液呈中性,根据电荷守恒得c(CH3COO-)=c(NH4+),
故答案为:=;
(3)A.苯酚的电离平衡常数小于一水合氨,所以苯酚铵溶液呈碱性,若混合液pH>7,则V≥10也可能小于10,故A错误;
B.若混合液pH<7,则苯酚过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(NH4+)<c(C6H5O-),故B错误;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,V=10时二者恰好反应生成苯酚铵,苯酚铵中水的电离被促进,苯酚中水的电离被抑制,混合液中水的电离程度大于10ml 0.01mol?L-1苯酚溶液中水的电离程度,故C错误;
D.V=5时,根据物料守恒得2c(NH3?H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH),故D正确;
故答案为:D;
(4)A.硫酸钠抑制硫酸钡电离,硫酸根离子浓度增大,导致溶液中钡离子浓度减小,所以可以使溶液由a点变为b点,故A正确;
B.在T1曲线上方区域(不含曲线)为过饱和溶液,所以有晶体析出,故B正确;
C.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变,所以蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),故C正确;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大,故D错误;
故答案为:D.
点评:本题考查了弱电解质的电离、酸碱混合溶液定性判断、难溶物的溶解平衡等知识点,这些知识点都是学习难点、考试热点,根据弱电解质的电离平衡特点、酸碱混合溶液酸碱性、溶度积常数等知识点来分析解答,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
下列有关化学用语中正确的是( )
| A、次氯酸分子的结构式:H-O-Cl |
B、聚丙烯的结构简式为: |
C、氮分子的结构式: |
D、丙烷分子的比例模型: |
化学反应的实质就是旧键的断裂和新键的形成.欲探讨发生化学反应时分子中化学键在何处断裂的问题,近代科技常用同位素示踪原子法.如有下列反应:2R-14CH═CH-R′
R-14CH═CH-R+R′-14CH═CH-R′
可以推知,物质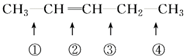 发生此反应时断裂的化学键应是( )
发生此反应时断裂的化学键应是( )
| 一定条件 |
可以推知,物质
 发生此反应时断裂的化学键应是( )
发生此反应时断裂的化学键应是( )| A、①④ | B、①③ | C、② | D、②③ |
将气体CO2通过MgCl2溶液中,若要有白色沉淀产生,可加入的试剂是( )
| A、KHSO4溶液 |
| B、CaCl2 |
| C、氯气 |
| D、NaOH溶液 |
对于下列装置所示的实验,有关说法正确的是( )
A、 双手移去后,导管中水面与烧杯水面相平,则说明装置不漏气 |
B、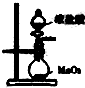 用于实验室制取Cl2 |
C、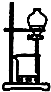 从海带中提取碘的实验过程中,用如图装置向烧杯中放出碘的苯溶液 |
D、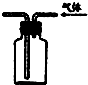 可用于实验室收集甲烷气体 |
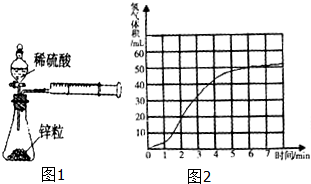 某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.
某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示. 化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题: