题目内容
下列离子方程式正确的是( )
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O→AlO2-+4NH4++2H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.二者反应生成氢氧化铝沉淀和碳酸氢钠;
B.二者发生氧化还原反应生成亚铁离子和碘单质;
C.二者反应生成氢氧化铝沉淀和铵根离子;
D.二者反应生成硫酸钡和水,且水的计量数是2.
B.二者发生氧化还原反应生成亚铁离子和碘单质;
C.二者反应生成氢氧化铝沉淀和铵根离子;
D.二者反应生成硫酸钡和水,且水的计量数是2.
解答:
解:A.二者反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故A正确;
B.二者发生氧化还原反应生成亚铁离子和碘单质,离子方程式为2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故B错误;
C.二者反应生成氢氧化铝沉淀和铵根离子,离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故C错误;
D.二者反应生成硫酸钡和水,且水的计量数是2,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;
故选A.
B.二者发生氧化还原反应生成亚铁离子和碘单质,离子方程式为2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故B错误;
C.二者反应生成氢氧化铝沉淀和铵根离子,离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故C错误;
D.二者反应生成硫酸钡和水,且水的计量数是2,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;
故选A.
点评:本题考查离子方程式正误判断,明确物质的性质及离子方程式书写规则即可解答,注意弱电解质、气体、沉淀、单质、氧化物等写化学式,易错选项是B,注意二者发生氧化还原反应,不是单纯的酸和碱的反应,为易错点.

练习册系列答案
相关题目
化学与社会、环境密切相关,下列有关说法正确的是( )
| A、绿色化学的核心是应用化学原理对环境污染进行治理 |
| B、氯气和氢氧化钠溶液和石灰乳得到的含氯化合物都具有漂白性 |
| C、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| D、对“地沟油”蒸馏可以获得汽油 |
下列有关化学用语中正确的是( )
| A、次氯酸分子的结构式:H-O-Cl |
B、聚丙烯的结构简式为: |
C、氮分子的结构式: |
D、丙烷分子的比例模型: |
下列实验设计能完成或实验结论合理的是( )
| A、证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾--淀粉试纸检验,观察试纸颜色的变化 |
| B、铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物 |
| C、将SO2通入Ba(NO3)2溶液,有白色沉淀生成,证明BaSO3难溶于硝酸 |
| D、在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 |

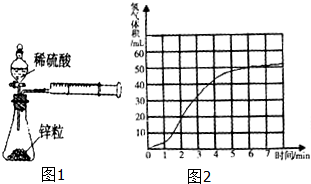 某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.
某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.