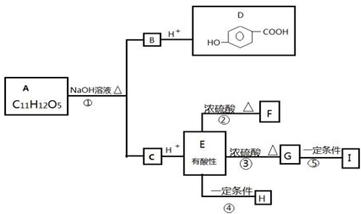
题目内容
(1)下列事实中,能证明亚硫酸的酸性强于氢硫酸(H2S的水溶液)的是 (填字母).
a.亚硫酸受热时易分解
b.相同条件下,亚硫酸的导电能力强于氢硫酸
c.亚硫酸溶液可使品红溶液褪色,而氢硫酸不能
d.常温下,浓度均为0.1mol?L-1的H2SO3溶液和H2S溶液的pH分别是2.1和4.5
(2)工业上除去高压锅炉用水中溶解的氧气常用的试剂有Na2SO4和N2H4(肼).
①已知16g液态的肼与氧气反应得到氢气和液态水时,放热354.84kJ,该反应的热化学方程式是 .
②除去等质量的O2,所耗Na2SO3和N2H4的质量比是 (填最简整数比)
(3)向Na2SO3和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀,则该反应中氧化剂和还原剂的物质的量之比是 .
(4)向Na2SO3溶液中滴入少量氯水后,用充分混合后的溶液证明二者发生了氧化还原反应的方法是(写出操作、试剂、现象、结论) .
(5)已知Na2SO3在高温下发生分解,得到两种产物.某同学称量25.2g纯净的Na2SO3?7H2O(摩尔质量252
g?mol-1)晶体在高温下隔绝空气加热至恒温,冷却后称得固体为12.6g,将其完全溶于水配成1L溶液,并测溶液的pH.
①测得溶液的pH大于0.1mol?L-1Na2SO3溶液的pH,原因(结合离子方程式说明) .
②Na2SO3高温分解的化学方程式是 .
a.亚硫酸受热时易分解
b.相同条件下,亚硫酸的导电能力强于氢硫酸
c.亚硫酸溶液可使品红溶液褪色,而氢硫酸不能
d.常温下,浓度均为0.1mol?L-1的H2SO3溶液和H2S溶液的pH分别是2.1和4.5
(2)工业上除去高压锅炉用水中溶解的氧气常用的试剂有Na2SO4和N2H4(肼).
①已知16g液态的肼与氧气反应得到氢气和液态水时,放热354.84kJ,该反应的热化学方程式是
②除去等质量的O2,所耗Na2SO3和N2H4的质量比是
(3)向Na2SO3和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀,则该反应中氧化剂和还原剂的物质的量之比是
(4)向Na2SO3溶液中滴入少量氯水后,用充分混合后的溶液证明二者发生了氧化还原反应的方法是(写出操作、试剂、现象、结论)
(5)已知Na2SO3在高温下发生分解,得到两种产物.某同学称量25.2g纯净的Na2SO3?7H2O(摩尔质量252
g?mol-1)晶体在高温下隔绝空气加热至恒温,冷却后称得固体为12.6g,将其完全溶于水配成1L溶液,并测溶液的pH.
①测得溶液的pH大于0.1mol?L-1Na2SO3溶液的pH,原因(结合离子方程式说明)
②Na2SO3高温分解的化学方程式是
考点:弱电解质在水溶液中的电离平衡,热化学方程式
专题:
分析:(1)弱酸不能完全电离,电离程度越差,离子浓度越小,弱酸的酸性越弱,据此分析;
(2)①16g肼为0.5mol,所以1mol肼燃烧放热709.68KJ,据已知条件书写热化学方程式;
②1molNa2SO3和N2H4反应,转移电子分别为2mol和4mol,据电子守恒解答;
(3)根据反应方程式分析;
(4)证明含有硫酸根离子即可;
(5)①含有结晶水的晶体,受热首先失去结晶水,根据硫的化合价分析,分解后的物质配成溶液,测得溶液的pH大于0.1mol?L-1Na2SO3溶液的pH,说明分解生成的一种物质的水解程度比Na2SO3大,则说明生成Na2S;
②根据硫的化合价分析,生成Na2S,根据化合价的变化可知,另一种物质为Na2SO4,据此书写化学方程式.
(2)①16g肼为0.5mol,所以1mol肼燃烧放热709.68KJ,据已知条件书写热化学方程式;
②1molNa2SO3和N2H4反应,转移电子分别为2mol和4mol,据电子守恒解答;
(3)根据反应方程式分析;
(4)证明含有硫酸根离子即可;
(5)①含有结晶水的晶体,受热首先失去结晶水,根据硫的化合价分析,分解后的物质配成溶液,测得溶液的pH大于0.1mol?L-1Na2SO3溶液的pH,说明分解生成的一种物质的水解程度比Na2SO3大,则说明生成Na2S;
②根据硫的化合价分析,生成Na2S,根据化合价的变化可知,另一种物质为Na2SO4,据此书写化学方程式.
解答:
解:(1)a、硝酸受热易分解,但硝酸是强酸,所以不能根据受热是否易分解判断酸的强弱,故错误;
b、相同条件下,亚硫酸的导电能力强于氢硫酸,说明亚硫酸电离程度大,酸性强,故正确;
c、亚硫酸溶液中含有二氧化硫具有漂白性,与酸性强弱无关,故错误;
d、浓度均为0.1mol?L-1的H2SO3溶液和H2S溶液的pH分别是2.1和4.5,说明亚硫酸电离程度大于氢硫酸,酸性强,故正确;
故答案为:bd;
(2))①16g肼为0.5mol,所以1mol肼燃烧放热709.68KJ,热化学方程式为:N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-709.74kJ?mol-1,
故答案为:N3H4(1)+O2(g)=N2(g)+2H2O(1);△H=-709.74kJ?mol-1;
②1molNa2SO3和N2H4被氧化,转移电子分别为2mol和4mol,除去等质量的O2,消耗Na2SO3和N2H4的物质的量之比为2:1,质量比为:
=7.875,
故答案为:7.875;
(3)向Na2SO3和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀,反应的方程式为:Na2SO3+2Na2S+6HCl=3↓S+6NaCl+3H2O,Na2S→S硫元素的化合价升高做还原剂,Na2SO3→S硫元素的化合价降低做氧化剂,则氧化剂和还原剂的物质的量之比是1:2;
故答案为:1:2;
(4)向Na2SO3溶液中滴入少量氯水后,氯气有氧化性能够氧化亚硫酸根离子,将其氧化为硫酸根离子,若通过实验能够证明有硫酸根存在,可以证明发生了氧化还原反应,用氯化钡溶液和稀盐酸即可证明,取少量混合后的溶液,向其中加入BaCl2溶液,若生成不溶于稀盐酸的白色沉淀,则证明发生了氧化还原反应,
故答案为:取少量混合后的溶液,向其中加入BaCl2溶液,若生成不溶于稀盐酸的白色沉淀,则证明发生了氧化还原反应;
(5)①含有结晶水的晶体,受热首先失去结晶水,根据硫的化合价分析,分解后的物质配成溶液,测得溶液的pH大于0.1mol?L-1Na2SO3溶液的pH,说明分解生成的一种物质的水解程度比Na2SO3大,则说明生成Na2S,S2-发生水解:S-+H2O?HS+OH-,其次解程度大于SO32-,所以混合液的pH大于NaSO3溶液,
故答案为:S2-发生水解:S-+H2O?HS+OH-,其次解程度大于SO32-,所以混合液的pH大于NaSO3溶液;
②25.2g纯净的 Na2SO3?7H2O晶体在高温下隔绝空气加热至恒重,冷却后称得固体为12.6g;
则n(Na2SO3?7H2O)=
=0.1mol,生成的气体的质量为25.2-12.6=12.6g,含有结晶水的晶体,受热首先失去结晶水,
若生成的是水蒸气则n(H2O)=
=0.7mol,则恰好满足Na2SO3?7H2O;
分解后的物质配成溶液,测得溶液的pH大于0.1mol?L-1Na2SO3溶液的pH,说明分解生成的一种物质的水解程度比Na2SO3大,则说明生成Na2S,根据化合价的变化可知,另一种物质为Na2SO4,则Na2SO3高温下分解的化学方程式4Na2SO3
3Na2SO4+Na2S;
故答案为:4Na2SO3
3Na2SO4+Na2S.
b、相同条件下,亚硫酸的导电能力强于氢硫酸,说明亚硫酸电离程度大,酸性强,故正确;
c、亚硫酸溶液中含有二氧化硫具有漂白性,与酸性强弱无关,故错误;
d、浓度均为0.1mol?L-1的H2SO3溶液和H2S溶液的pH分别是2.1和4.5,说明亚硫酸电离程度大于氢硫酸,酸性强,故正确;
故答案为:bd;
(2))①16g肼为0.5mol,所以1mol肼燃烧放热709.68KJ,热化学方程式为:N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-709.74kJ?mol-1,
故答案为:N3H4(1)+O2(g)=N2(g)+2H2O(1);△H=-709.74kJ?mol-1;
②1molNa2SO3和N2H4被氧化,转移电子分别为2mol和4mol,除去等质量的O2,消耗Na2SO3和N2H4的物质的量之比为2:1,质量比为:
| 126g×2 |
| 32g |
故答案为:7.875;
(3)向Na2SO3和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀,反应的方程式为:Na2SO3+2Na2S+6HCl=3↓S+6NaCl+3H2O,Na2S→S硫元素的化合价升高做还原剂,Na2SO3→S硫元素的化合价降低做氧化剂,则氧化剂和还原剂的物质的量之比是1:2;
故答案为:1:2;
(4)向Na2SO3溶液中滴入少量氯水后,氯气有氧化性能够氧化亚硫酸根离子,将其氧化为硫酸根离子,若通过实验能够证明有硫酸根存在,可以证明发生了氧化还原反应,用氯化钡溶液和稀盐酸即可证明,取少量混合后的溶液,向其中加入BaCl2溶液,若生成不溶于稀盐酸的白色沉淀,则证明发生了氧化还原反应,
故答案为:取少量混合后的溶液,向其中加入BaCl2溶液,若生成不溶于稀盐酸的白色沉淀,则证明发生了氧化还原反应;
(5)①含有结晶水的晶体,受热首先失去结晶水,根据硫的化合价分析,分解后的物质配成溶液,测得溶液的pH大于0.1mol?L-1Na2SO3溶液的pH,说明分解生成的一种物质的水解程度比Na2SO3大,则说明生成Na2S,S2-发生水解:S-+H2O?HS+OH-,其次解程度大于SO32-,所以混合液的pH大于NaSO3溶液,
故答案为:S2-发生水解:S-+H2O?HS+OH-,其次解程度大于SO32-,所以混合液的pH大于NaSO3溶液;
②25.2g纯净的 Na2SO3?7H2O晶体在高温下隔绝空气加热至恒重,冷却后称得固体为12.6g;
则n(Na2SO3?7H2O)=
| 25.2g |
| 252g/mol |
若生成的是水蒸气则n(H2O)=
| 12.6g |
| 18g/mol |
分解后的物质配成溶液,测得溶液的pH大于0.1mol?L-1Na2SO3溶液的pH,说明分解生成的一种物质的水解程度比Na2SO3大,则说明生成Na2S,根据化合价的变化可知,另一种物质为Na2SO4,则Na2SO3高温下分解的化学方程式4Na2SO3
| ||
故答案为:4Na2SO3
| ||
点评:本题考查了弱酸酸性强弱的判断、热化学方程式书写、氧化还原反应中的电子守恒、离子检验、化学方程式书写,题目难度较大.

练习册系列答案
相关题目
下列反应中,不属于氧化还原反应的是( )
| A、2NaBr+Cl2=2NaCl+Br2 |
| B、AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl |
| C、2H2S+SO2=2H2O+3S↓ |
| D、2FeCl3+H2S=2FeCl2+S↓+2HCl |
下列离子方程式正确的是( )
| A、金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、Ag2S沉淀溶解平衡表达式:Ag2S?2Ag++S2- |
| C、氢硫酸与硫酸铜反应:S2-+Cu2+=CuS↓ |
| D、NaHCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
下列说法正确的是( )
| A、0.01mol/L的Na2HPO4溶液中存在如下的平衡;HPO42-?H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小 |
| B、饱和NH4Cl中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3?H2O)+c(OH-) |
| C、常温下,0.1mol/L的HA和BOH两种溶液,其pH值分别为3和12,将两溶液等体积混合后,所得溶液的pH≤7 |
| D、在NH4HSO3与NH4Cl混合溶液中:c(NH4+)=c(SO32-)+c(HSO3-)+c(H2SO3)+c(Cl-) |
 工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表: