题目内容
16.离子是构成物质的基本微粒之一,下表中是中学常见的离子:| 阳离子 | K+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、SO42-、CO32- |
(1)Cl-离子的结构示意图是
 . Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.
. Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.(2)将含OH-离子的溶液 滴入浓度均为0.1 mol/L的Al3+和NH4+的混合溶液中,若测得溶液中NH4+减少了一半,此时,溶液中不存在(填“存在”或“不存在”)大量的Al3+.
(3)物质A和B分别由上表中的两种离子组成,将它们分别溶于水中,A的溶液显酸性,将A、B两溶液混合,微热,既有白色沉淀,又有使湿润的红色石蕊试纸变蓝的气体生成.
则B的阳离子是Ba2+,用离子方程式表示A溶液显酸性的原因NH4++H2O
 NH3•H2O+H+.
NH3•H2O+H+.(4)常温下,将(NH4)2CO3溶于水,得到含有大量NH4+和CO32-的溶液,往溶液中滴入少量氨水,测得溶液中N H4+和CO32 -的浓度比为2:1,此时该溶液的pH<( 填“<”、“=”或“>”)7.
(5)在微生物作用的条件下,NH4+可被空气氧化成NO3-.写出该反应的离子方程式:NH4++2O2=NO3-+H2O+2H+.
(6)在一个固定容积为5L的密闭容器中充入0.10mol N2和0.30molH2,一定条件下,半分钟后达到平衡,测得容器中含NH3 0.08mol,则ν(H2)=0.048mol.L-1.min-1,此时N2的转化率为40%;若继续通入0.10mol N2和0.30molH2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”).
分析 (1)氯离子核外有18个电子,有3个电子层,各层电子数为2、8、8;
Al3+、K+、SO42-三种离子可组成一种盐为明矾,可以用作净水剂;
(2)由于Al3+与氨水反应生成氢氧化铝沉淀,则OH-离子先与Al3+反应生成氢氧化铝沉淀,Al3+反应完毕,OH-离子再与NH4+离子反应;
(3)物质A和B分别由上表中的两种离子组成,将它们分别溶于水中,将A、B两溶液混合,微热,既有使湿润的红色石蕊试纸变蓝的气体生成,该气体为氨气,应是NH4+与OH-反应,且有白色沉淀生成、A的溶液显酸性,则A中含有弱碱根离子NH4+,B中含有OH-,A为(NH4)2SO4、B为Ba(OH)2;
(4)根据电荷守恒可知:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-),由于c(NH4+)=2c(CO32-),则c(H+)=c(HCO3-)+c(OH-);
(5)NH4+可被空气氧化成NO3-,反应物为铵根离子和氧气,生成物硝酸根离子,根据电荷守恒和质量守恒定律可知反应产物中还有水和氢离子;
(6)在一个固定容积为5L的密闭容器中充入0.10mol N2和0.30molH2,一定条件下,半分钟后达到平衡,测得容器中含NH3 0.08mol,则:
N2(g)+3H2(g)?2NH3 (g)
起始量(mol):0.1 0.3 0
变化量(mol):0.04 0.12 0.08
平衡量(mol):0.06 0.18 0.08
根据v=$\frac{△c}{△t}$计算ν(H2),转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
若继续通入0.10mol N2和0.30molH2,反应物浓度增大,平衡正向移动.
解答 解:(1)氯离子核外有18个电子,有3个电子层,各层电子数为2、8、8,离子结构示意图为: ;
;
Al3+、K+、SO42-三种离子可组成一种盐为明矾,可以用作净水剂,
故答案为: ;净水剂;
;净水剂;
(2)由于Al3+与氨水反应生成氢氧化铝沉淀,则OH-离子先与Al3+反应生成氢氧化铝沉淀,Al3+反应完毕,OH-离子再与NH4+离子反应,所以溶液中NH4+减少了一半,则铝离子一定不会大量存在,
故答案为:不存在;
(3)物质A和B分别由上表中的两种离子组成,将它们分别溶于水中,将A、B两溶液混合,微热,既有使湿润的红色石蕊试纸变蓝的气体生成,该气体为氨气,应是NH4+与OH-反应,且有白色沉淀生成、A的溶液显酸性,则A中含有弱碱根离子NH4+,B中含有OH-,A为(NH4)2SO4、B为Ba(OH)2,则B的阳离子是Ba2+,用离子方程式表示A溶液显酸性的原因:NH4++H2O NH3•H2O+H+,
NH3•H2O+H+,
故答案为:Ba2+;NH4++H2O NH3•H2O+H+;
NH3•H2O+H+;
(4)根据电荷守恒可知:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-),由于c(NH4+)=2c(CO32-),则c(H+)=c(HCO3-)+c(OH-),所以溶液中c(H+)>c(OH-),所以溶液显示酸性,
故答案为:<;
(5)在微生物作用的条件下,NH4+可被空气氧化成NO3-,反应中N化合价升高被氧化,空气中的氧气化合价降低被还原,根据电荷守恒、质量守恒定律可以判断,反应产物为水和氢离子,所以反应的离子方程式为:NH4++2O2=NO3-+H2O+2H+,
故答案为:NH4++2O2=NO3-+H2O+2H+;
(6)在一个固定容积为5L的密闭容器中充入0.10mol N2和0.30molH2,一定条件下,半分钟后达到平衡,测得容器中含NH3 0.08mol,则:
N2(g)+3H2(g)?2NH3 (g)
起始量(mol):0.1 0.3 0
变化量(mol):0.04 0.12 0.08
平衡量(mol):0.06 0.18 0.08
ν(H2)=$\frac{\frac{0.12mol}{5L}}{0.5min}$=0.048mol/(L.min),氮气的转化率=$\frac{0.04mol}{0.1mol}$×100%=40%;
若继续通入0.10mol N2和0.30molH2,反应物浓度增大,平衡正向移动,
故答案为:0.048;40%;向正反应方向.
点评 本题考查化学平衡计算、盐的水解原理及其应用、未知物的推断、常用化学用语等知识,题目难度中等,试题涉及的知识点较多,注意掌握常见离子的检验方法,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | K+、Br-、Cl-、SO42- | B. | SCN-、Fe3+、Cl-、K+ | ||
| C. | K+、Cu2+、SO42-、Na+ | D. | Na+、ClO-、NO3-、SO42- |
| A. | 铁是一种非常活泼的金属 | B. | 镁可以与氧气反应生成氧化镁 | ||
| C. | 钠的硬度大 | D. | 铝的常见氧化物是Al3O4 |
| A. | Na+、Mg2+、Cl-、OH- | B. | H+、Ca2+、CO32-、NO3- | ||
| C. | Cu2+、K+、SO42-、NO3- | D. | Na+、HCO3-、K+、H+ |

| A. | 2SO2(g)+O2(g)?2SO3(g);△H<0 | B. | 4NH3(g)+O2(g)?4NO(g)+6H2O (g);△H<0 | ||
| C. | H2(g)+I2(g)?2HI (g);△H>0 | D. | C (s)+H2O (g)?CO (g)+H2 (g);△H>0 |
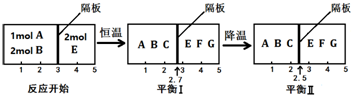
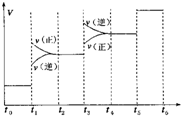 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.