题目内容
11.可逆反应①A(g)+2B(g)?2C(g) ②2E(g)?F(g)+G(g) 分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板.反应开始和达到平衡时有关物理量变化如图所示: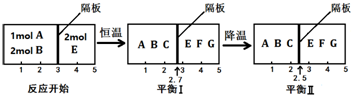
(1)反应①是放热反应(填“放热”或“吸热”).
(2)达到平衡I时,体系压强与反应开始时体系压强之比为20:23.
(3)平衡I和平衡Ⅱ中,E的体积分数不相等(填“相等”、“不相等”、“无法确定”).
(4)达平衡I时,计算A的转化率$\frac{15}{23}$(用分数表示).
分析 (1)右室的混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,由图可知,平衡(I)降低温度达新平衡平衡(Ⅱ),隔板由2.7处移至2.5处,左室的气体的物质的量减小,降低温度平衡向正反应移动;
(2)右室中混合气体总物质的量不变,温度恒定,则达到平衡I时,体系压强与反应开始时体系压强之比等于体积之比;
(3)降低温度,右室的平衡一定移动,气体总的物质的量不变,E的含量一定变化;
(4)右室的混合物总物质的量不变为2mol,左右两室的压强、温度相等,同温同压下,体积之比等于物质的量之比,据此计算平衡(I)中左室混合气体总的物质的量,令参加反应的A的物质的量为amol,利用差量法计算a的值,再利用转化率定义计算A的转化率.
解答 解:(1)右室的混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,由图可知,平衡(I)降低温度达新平衡平衡(Ⅱ),隔板由2.7处移至2.5处,左室的气体的物质的量减小,降低温度平衡向正反应移动,降低温度平衡向放热反应移动,故该反应正反应为放热反应,
故答案为:放热;
(2)右室中混合气体总物质的量不变,温度恒定,则达到平衡I时,体系压强与反应开始时体系压强之比等于体积之比,即压强之比为2:(5-2.7)=20:23,
故答案为:20:23;
(3)降低温度,右室的平衡一定移动,气体总的物质的量不变,E的含量一定变化,平衡(I)和平衡(Ⅱ)中,E的体积分数一定不相等,
故答案为:不相等;
(4)右室的混合物总物质的量不变为2mol,左右两室的压强、温度相等,同温同压下,体积之比等于物质的量之比,平衡(I)中左室混合气体总的物质的量为$\frac{2.7}{2.3}$×2mol=$\frac{54}{23}$mol,令参加反应的A的物质的量为amol,则:
A(g)+2B(g)?2C(g) 物质的量减少△n
1 1
amol 3mol-$\frac{54}{23}$mol=$\frac{15}{23}$mol
解得a=$\frac{15}{23}$,所以A的转化率为$\frac{\frac{15}{23}mol}{1mol}$=$\frac{15}{23}$,
故答案为:$\frac{15}{23}$.
点评 本题主要考查了化学平衡移动与化学计算等,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力,清楚左右两室的温度、压强相同,体积之比等于物质的量之比是解题关键,难度中等.

| A. | 14CO2的结构式为O═14C═O | B. | 14CO2和12CO2互为同分异构体 | ||
| C. | 14C和12C互为同素异形体 | D. | 14CO2和Na218O2反应生成15O2 |
| A. | 硫酸铝中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝与盐酸反应:2Al(OH)3+6H+═2Al3++6H20 | |
| C. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 偏铝酸钠溶液与适量稀硝酸反应:AlO2-+H++H20═Al(OH)3↓ |
| 阳离子 | K+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、SO42-、CO32- |
(1)Cl-离子的结构示意图是
 . Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.
. Al3+、K+、SO42-三种离子可组成一种盐,写出该盐的一种用途净水剂.(2)将含OH-离子的溶液 滴入浓度均为0.1 mol/L的Al3+和NH4+的混合溶液中,若测得溶液中NH4+减少了一半,此时,溶液中不存在(填“存在”或“不存在”)大量的Al3+.
(3)物质A和B分别由上表中的两种离子组成,将它们分别溶于水中,A的溶液显酸性,将A、B两溶液混合,微热,既有白色沉淀,又有使湿润的红色石蕊试纸变蓝的气体生成.
则B的阳离子是Ba2+,用离子方程式表示A溶液显酸性的原因NH4++H2O
 NH3•H2O+H+.
NH3•H2O+H+.(4)常温下,将(NH4)2CO3溶于水,得到含有大量NH4+和CO32-的溶液,往溶液中滴入少量氨水,测得溶液中N H4+和CO32 -的浓度比为2:1,此时该溶液的pH<( 填“<”、“=”或“>”)7.
(5)在微生物作用的条件下,NH4+可被空气氧化成NO3-.写出该反应的离子方程式:NH4++2O2=NO3-+H2O+2H+.
(6)在一个固定容积为5L的密闭容器中充入0.10mol N2和0.30molH2,一定条件下,半分钟后达到平衡,测得容器中含NH3 0.08mol,则ν(H2)=0.048mol.L-1.min-1,此时N2的转化率为40%;若继续通入0.10mol N2和0.30molH2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”).
 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H(1)已知:
①3Fe(s)+2O2(g)?Fe3O4(s)△H 1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示 加入物质,在t℃时反应经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是B(填序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(3)若将(2)中装置改为恒容绝热(不与外界交换能量)的装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
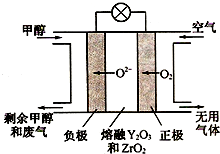
(4)一种以甲醇做燃料的电池示意图如图,写出该电池放电时负极的电极反应式:CH3OH-6e-+3O2-=CO2↑+2H2O.
(1)己知N2O4(g)═2NO2(g)△H=+57.20kJ/mol,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②20min时改变的条件是增大二氧化氮浓度;重新达到平衡时,NO2的转化率将b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断
③t℃时,下列情况不能说明该反应处于平衡状态的是A;
A.混合气体的密度保持不变 B.混合气体的颜色不再变化
C.混合气体的气体压强保持不变 D.N2O4 与NO2的物质的量比为10:3
④若反应在t℃进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时v(正)>v(逆)(填“>”、“<”或“=”).
(2)已知2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225kJ/mol
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ/mol) | 390 | 190 | 946 | 460 |
 向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.